题目内容
14.在某溶液中加入KSCN溶液,无明显现象.再滴入少量氯水,溶液变为红色.试判断( )| A. | 溶液中一定有Fe3+ | B. | 溶液中一定无Fe2+ | ||
| C. | 溶液中一定有Fe2+ | D. | 无法确定 |
分析 某溶液中加入KSCN溶液无明显现象,说明原溶液中本来无Fe3+,再通入氯气,溶液立即变为红色,说明通入氯气后生成了Fe3+,以此解答该题.
解答 解:铁离子Fe3+的检验方法是在溶液中加入硫氰酸钾溶液,溶液变为血红色,证明是含有三价铁离子.
某溶液中加入KSCN溶液无明显现象,说明原溶液中本来无Fe3+,再滴加氯水,溶液立即变为血红色,说明通入氯气后生成了Fe3+,即说明原溶液含有亚铁离子,加入氯水发生反应2Fe2++Cl2=2Fe3++2Cl-,被氧化生成的铁离子和硫氰酸根离子生成血红色溶液.
故选C.
点评 本题考查离子的检验以及亚铁离子、铁离子的性质,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
14.甲、乙、丙、丁都是第三周期元素形成的单质,下列叙述正确的是( )
| A. | 1mol单质甲完全燃烧生成的氧化物与热烧碱溶液反应,最多消耗3 mol NaOH,甲的分子结构为正四面体 | |
| B. | 1mol单质乙完全燃烧生成的氧化物与烧碱溶液反应,最多消耗1 mol NaOH,乙的氧化物的熔点较低 | |
| C. | 1mol单质丙完全燃烧生成的氧化物与烧碱溶液反应,最多消耗2 mol NaOH,晶体丙是原子晶体 | |
| D. | 1mol单质丁完全燃烧生成的氧化物与烧碱溶液反应,最多消耗2 mol NaOH,丁可能是良好的半导体 |
9.下列说法不正确的是( )
| A. | CH3-CH═CH2和CH2═CH2的最简式相同 | |
| B. | 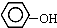 与 与 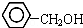 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
6.下列有机物不能通过乙烯的加成反应制取的是( )
| A. | CH3CHCl2 | B. | CH2Cl-CH2Cl | C. | CH3-CH2OH | D. | CH3-COOH |
3.几种短周期元素的原子半径及主要化合价见下表
下列说法正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/mm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、Q形成的简单离子核外电子数相等 | |
| B. | M与T形成的化合物能与NaOH溶液反应 | |
| C. | Q、T两元素的氢化物的稳定性:H2T<H2Q | |
| D. | L、R的单质与盐酸反应速率为R>L |
4.下列离子在强酸性溶液中能大量共存的是( )
| A. | Fe3+,NH4+,SCN-,Cl- | B. | Na+,Cl-,NO3-,SO42- | ||
| C. | Fe2+,Cl-,Na+,NO3- | D. | Fe2+,NH4+,Cl-,OH- |
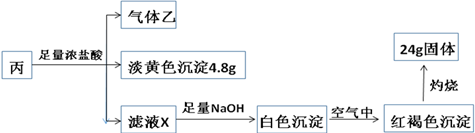
 燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图.按要求完成下列问题:
燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图.按要求完成下列问题: