题目内容
20.某同学按如图所示的装置做实验,并把实验情况记录于框内.你认为框内叙述合理的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ③④⑥ | D. | ②③④ |
分析 Zn-Cu原电池中,Zn作负极,铜为正极,发生电池总反应为Zn+2H+=Zn2++H2↑,阳离子向正极移动,以此来解答.
解答 解:①Zn为负极,Cu为正极,故①错误;
②电池总反应为Zn+2H+=Zn2++H2↑,反应消耗酸,溶液pH增大,故②错误;
③形成原电池反应,电流表指针发生偏转,故③正确;
④Cu电极上发生2H++2e-=H2↑,则有气泡产生,故④正确;
⑤Zn为负极失电子,不断溶解变薄,故⑤正确;
⑥原电池工作时,阳离子向正极移动,故⑥错误.
故选B.
点评 本题考查原电池,为高频考点,侧重于学生的分析能力的考查,明确电极的判断、发生的电极反应、离子的移动方向即可解答,题目难度不大.

练习册系列答案
相关题目
10.亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2反应得到,化学方程式为
2NO(g)+Cl2(g)?2ClNO(g)
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2Cl2(g)+2NO(g)△H2 K2
③2NO(g)+Cl2(g)?2ClNO(g)△H3 K3
△H1、△H2、△H3之间的关系式为2△H1-△H2;平衡常数K1、K2、K3之间的关系式为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表:
则△H3+2a=289kJ/mol.
(3)300℃时,2ClNO(g)?2NO(g)+Cl2(g)的正反应速率的表达式为v正=k•cn(ClNO)(k为速率常数,只与温度有关),测得塑料厂与浓度关系如表所示:
n=2,k=4.0×10-7mol-1•L•s-1.
(4)在两个容积均为2L的恒容密闭容器中分别加入4mol和2mol ClNO,在不同温度下发生反应:2ClNO(g)?2NO(g)+Cl2(g),达道平衡时ClNO的浓度随温度变化的曲线如图1所示(图中ABC点均位于曲线上).

①2ClNO(g)?2NO(g)+Cl2(g)△S>0(选填“>”“<”或“=”).
②A、B两点平衡常数之比为K(A):K(B)=1:27.
③B、C两点ClNO的转化率a(B)< a(C) (选填“>”“<”或“=”).
(5)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-748KJ/mol
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低.
②已知:测定空气中NO和CO含量可用电化学气敏传感器法.其中CO传感器的工作原理如图3所示,则工作电极的反应式为CO-2e-+H2O═CO2+2H+.
2NO(g)+Cl2(g)?2ClNO(g)
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2Cl2(g)+2NO(g)△H2 K2
③2NO(g)+Cl2(g)?2ClNO(g)△H3 K3
△H1、△H2、△H3之间的关系式为2△H1-△H2;平衡常数K1、K2、K3之间的关系式为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表:
| 化学键 | NO中的氮氧键 | Cl-Cl键 | Cl-N键 | ClNO中的N=O键 |
| 键能/(KJ/mol) | 630 | 243 | a | 607 |
(3)300℃时,2ClNO(g)?2NO(g)+Cl2(g)的正反应速率的表达式为v正=k•cn(ClNO)(k为速率常数,只与温度有关),测得塑料厂与浓度关系如表所示:
| 序数 | c(ClNO)/(mol/L) | v/(mol•L•s) |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(4)在两个容积均为2L的恒容密闭容器中分别加入4mol和2mol ClNO,在不同温度下发生反应:2ClNO(g)?2NO(g)+Cl2(g),达道平衡时ClNO的浓度随温度变化的曲线如图1所示(图中ABC点均位于曲线上).

①2ClNO(g)?2NO(g)+Cl2(g)△S>0(选填“>”“<”或“=”).
②A、B两点平衡常数之比为K(A):K(B)=1:27.
③B、C两点ClNO的转化率a(B)< a(C) (选填“>”“<”或“=”).
(5)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-748KJ/mol
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低.
②已知:测定空气中NO和CO含量可用电化学气敏传感器法.其中CO传感器的工作原理如图3所示,则工作电极的反应式为CO-2e-+H2O═CO2+2H+.
11.下列关于乙酸的叙述正确的是( )
| A. | 乙酸酸性较弱,不能使紫色石蕊变红 | |
| B. | 乙酸在常温下能与NaOH、Na2CO3、乙醇等发生化学反应 | |
| C. | 在发生酯化反应时,乙酸分子羟基中的氢原子跟醇分子中的羟基结合成水 | |
| D. | 乙酸分子中既有极性键,又有非极性键 |
8.由铁、石墨、稀盐酸组成的原电池工作时,下列叙述正确的是( )
| A. | 铁电极为负极 | B. | 石墨电极为负极 | ||
| C. | 氢离子向铁电极移动 | D. | 正极发生氧化反应 |
15.下列关于苯(如图所示)的叙述正确的是( )


| A. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| B. | 反应①常温下能进行,其有机产物为 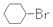 | |
| C. | 反应③为加成反应,产物是三硝基甲苯 | |
| D. | 反应④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
5.电解饱和食盐水时,先要精制盐水,以除去SO42-、Mg2+、Ca2+,通常依次加入的溶液是( )
| A. | BaCl2、NaOH、Na2CO3、HCl | B. | Na2CO3、BaCl2、NaOH、HCl | ||
| C. | BaCl2、HCl、Na2CO3、NaOH | D. | Na2CO3、BaCl2、HCl、NaOH |
12.化合物G(结构如图)是合成抗癌药氨柔比星的中间体.下列说法正确的是( )


| A. | 该有机物的分子式为C12H15NO4 | |
| B. | 该有机物分子中所有原子一定在同一平面上 | |
| C. | 该有机物可以发生取代、加成和氧化反应 | |
| D. | 该有机物既可与NaHCO3溶液反应,又可与NaOH溶液反应 |
9.下列关于乙醇和乙酸的说法正确的是( )
| A. | 都难溶于水 | B. | 都能使紫色石蕊试液变红 | ||
| C. | 都能和CaCO3反应 | D. | 都能发生酯化反应 |
14.下列有关说法正确的是( )
| A. | 化学实验室规则需人人遵守,进入实验室应先用蒸馏水清洗自己要使用的仪器 | |
| B. | 不小心将烧碱溶液溅到手上时,应先用大量水冲洗,然后涂抹一定浓度的NaHCO3溶液 | |
| C. | 化学药品应分类存放,盛装HF的玻璃瓶应存放在酸类物质的储存柜中 | |
| D. | Na应保存在煤油中,使用时用镊子夹出,用小刀切割,剩余的Na应放回原瓶 |