题目内容
11.下列关于乙酸的叙述正确的是( )| A. | 乙酸酸性较弱,不能使紫色石蕊变红 | |
| B. | 乙酸在常温下能与NaOH、Na2CO3、乙醇等发生化学反应 | |
| C. | 在发生酯化反应时,乙酸分子羟基中的氢原子跟醇分子中的羟基结合成水 | |
| D. | 乙酸分子中既有极性键,又有非极性键 |
分析 乙酸含-COOH,具有酸性,可发生酯化反应,且含C-C非极性键、O-H极性键,以此来解答.
解答 解:A.含-COOH,具有酸性,酸性比碳酸强,能使紫色石蕊变红,故A错误;
B.乙酸在常温下能与NaOH、Na2CO3反应,常温下与乙醇不反应,故B错误;
C.酯化反应时,乙酸脱羟基,醇脱H,故C错误;
D.乙酸分子含C-C非极性键、O-H极性键,故D正确;
故选D.
点评 本题考查有机物的性质及化学键,为高频考点,把握官能团与性质的关系、有机反应、共价键判断为解本题关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
相关题目
2.如图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显-3价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )

| A. | H+透过质子交换膜由右向左移动 | |
| B. | 铜电极应与X相连接 | |
| C. | M电极的反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.5 mol气体时,则铁电极增重32 g |
19.已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol•L-1的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或c),其中一定正确的一组是( )
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | B. | c(Na+)+c(H+)=c(HRO3-)+2c(RO3-)+c(OH-) | ||
| C. | c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-) | D. | 以上都不正确 |
16.下列烃中只属于烯烃的是( )
| A. |  | B. |  | ||
| C. |  | D. | CH2═CH-CH2-CH2-CH2Cl |
3.运用元素周期律分析下面推断,其中错误的是( )
| A. | 硒化氢(H2Se)是有毒的气体,比H2S稳定 | |
| B. | 砹为有色固体,HAt不稳定 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 铍(Be)的氧化物的水化物可能具有两性 |
20.某同学按如图所示的装置做实验,并把实验情况记录于框内.你认为框内叙述合理的是( ) 

| A. | ①②③ | B. | ③④⑤ | C. | ③④⑥ | D. | ②③④ |
1.以石墨为电极,电解KI溶液(其中含有少量酚酞).下列说法正确的是( )
| A. | 阴极逸出气体 | B. | 阳极附近溶液呈红色 | ||
| C. | K+向阳极迁移 | D. | 溶液的pH逐渐变小 |
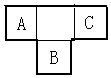 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.且含B元素物质的大量燃烧是形成酸雨的主要原因之一.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.且含B元素物质的大量燃烧是形成酸雨的主要原因之一.  ,用电子式表示元素B的钠盐的形成过程:
,用电子式表示元素B的钠盐的形成过程: .
.