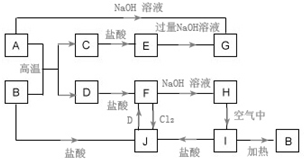
题目内容
13.常温下,现有体积相同、pH均为2的盐酸和醋酸溶液,下列说法不正确的是( )| A. | 盐酸中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 | |
| B. | 分别与足量CaCO3反应,放出的CO2一样多 | |
| C. | 分别用水稀释相同倍数,n(Cl-)<n(CH3COO-) | |
| D. | 分别将两溶液升温至80℃,醋酸溶液的pH变小,盐酸的pH不变(不考虑挥发) |
分析 盐酸是强酸,醋酸是弱酸,所以醋酸溶液中存在电离平衡,pH相同的醋酸和盐酸,溶液中c(H+)相同,但是醋酸的浓度大于盐酸,据此分析.
解答 解:A.两种溶液中c(H+)相同,由电荷守恒可知,c(H+)=c(Cl-)+c(OH-),c(H+)=c(CH3COO-)+c(OH-),所以两种溶液的n(Cl-)=n(CH3COO-)相同,故A正确;
B.它们分别与足量CaCO3反应时,醋酸的物质的量多,与醋酸反应生成的CO2多,故B错误;
C.分别用水稀释相同倍数时,促进醋酸的电离,醋酸中醋酸根离子的物质的量增大,而盐酸中氯离子的物质的量不变,所以n(Cl-)<n(CH3COO-),故C正确;
D.醋酸中存在电离平衡,升高温度,促进醋酸的电离,醋酸中氢离子浓度增大,则pH减小,升高温度,盐酸中氢离子浓度基本不变,所以pH不变,故D正确.
故选B.
点评 本题考查了弱电解质的电离平衡应用、溶液pH的变化、溶液稀释后溶液中离子浓度的分析判断,把握弱电解质的电离平衡变化分析是解题关键,题目难度中等.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
3.能鉴别KI、AgNO3、Na2CO3、NaAlO2四种溶液的试剂是( )
| A. | HCl | B. | KOH | C. | BaCl2 | D. | HNO3 |
18.下列各选项中所述的两个量,前者一定大于后者的是( ) )
| A. | 室温下,1L0.3mol•L-1CH3COOH溶液和3L0.1 mol•L-1CH3COOH溶液中的H+数 | |
| B. | 纯水在25℃和80℃时的pH | |
| C. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 | |
| D. | 相同条件下,H2分别与Cl2、F2反应的反应速率 |
5.下列有关实验的说法正确的是( )
| A. | 为测定熔融氢氧化钠的导电性,可在氧化铝坩埚中熔化氢氧化钠固体后进行测量 | |
| B. | Fe(OH)3胶体可以将Fe Cl3滴入NaOH溶液中进行制备 | |
| C. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |