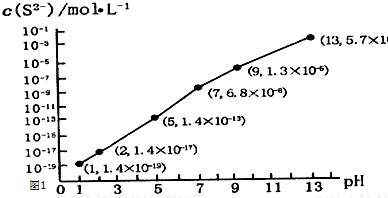
题目内容
20.实验室用锌与稀硫酸制取氢气,欲提高反应速率可采取的措施是( )| A. | 将稀硫酸改成浓硫酸 | B. | 将纯锌换成含铜、铅等杂质的粗锌 | ||
| C. | 往稀硫酸中滴加浓度更大的硝酸 | D. | 往稀硫酸中加入K2SO4溶液 |
分析 对于锌与稀硫酸的反应,影响反应速率的因素有浓度、温度以及固体表面积等,一般来说,增大浓度、升高温度或增大固体表面积等,可增大反应速率,以此解答.
解答 解:A.浓硫酸和铁发生钝化现象且反应生成二氧化硫而不是氢气,故A错误;
B.将纯锌换成含铜、铅等杂质的粗锌,可形成原电池反应,增大反应速率,故B正确;
C.加入硝酸,生成NO气体,不生成氢气,故C错误;
D.往稀硫酸中加入K2SO4溶液,溶液体积增大,浓度减小,反应速率减小,故D错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 乙醇和乙酸之间能发生酯化反应,在浓硫酸的作用下乙醇和乙酸有一种能消耗完 |
5.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备手机电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| C. | 元素X与氢形成的化合物可能既有极性键又有非极性键 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
12. 如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
 如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )| A. | 该能量转化系统工作时,需不断补充H2O | |
| B. | 该转化系统的能量本质上来源于太阳能 | |
| C. | 水电解系统中的阴极反应:O2+2H2O+4e-═4OH- | |
| D. | 燃料电池放电时的负极反应:H2-2e-═2H+ |
9.下列说法正确的是( )
| A. | 常温下,将pH=10的氨水溶液稀释到原体积的10倍后,溶液的pH=9 | |
| B. | 25℃时,分别向体积均为10mL pH=3的HCl和pH=3的CH3COOH溶液中,滴加0.1mol•L-1的NaOH溶液,至中性时,盐酸消耗的氢氧化钠体积多 | |
| C. | 向0.05mol•L-1的Na2CO3溶液中加入0.05mol CaO,溶液中$\frac{c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$减小 | |
| D. | 25℃时氯气-氯水体系汇总存在以下平衡关系:c(H+)-c(OH-)=2c(ClO-)+c(HClO) |
6.a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.下列叙述错误的是( )
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与其他元素生成的化合物都是离子化合物 | |
| D. | a.b.c.d与氢形成的化合物中化学键均为极性共价键 |