题目内容
短周期元素A、B、C、D、E中,A元素的离子得到2个电子被还原为中性原子,A的质量数是24,A原子核内质子数目与中子数目相等;B元素原子核外M层电子数目比K层少1个,C-比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子;E元素的原子核外只有一个电子
(1)A、B、C、D四种元素的符号分别是 、 、 、 .
(2)画出C-的离子结构示意图
(3)写出B与水反应的化学方程式 ;C与E反应的化学方程式 .
(4)D与E以原子个数为1:4形成的化合物的化学式是 ,其中化学键的类型是 共价键(填“极性”或“非极性”).
(1)A、B、C、D四种元素的符号分别是
(2)画出C-的离子结构示意图
(3)写出B与水反应的化学方程式
(4)D与E以原子个数为1:4形成的化合物的化学式是
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D、E中,A元素的离子得到2个电子被还原为中性原子,A的质量数是24,A原子核内质子数目与中子数目相等,则A元素的质子数是12,为Mg元素;
B元素原子核外M层电子数目比K层少1个,则B元素是Na元素;
C-比A元素的离子多1个电子层,则C是Cl元素;
D元素的原子核外L层比K层多2个电子,则D元素是C元素;
E元素的原子核外只有一个电子,则E是H元素,据此分析解答.
B元素原子核外M层电子数目比K层少1个,则B元素是Na元素;
C-比A元素的离子多1个电子层,则C是Cl元素;
D元素的原子核外L层比K层多2个电子,则D元素是C元素;
E元素的原子核外只有一个电子,则E是H元素,据此分析解答.
解答:
解:短周期元素A、B、C、D、E中,A元素的离子得到2个电子被还原为中性原子,A的质量数是24,A原子核内质子数目与中子数目相等,则A元素的质子数是12,为Mg元素;
B元素原子核外M层电子数目比K层少1个,则B元素是Na元素;
C-比A元素的离子多1个电子层,则C是Cl元素;
D元素的原子核外L层比K层多2个电子,则D元素是C元素;
E元素的原子核外只有一个电子,则E是H元素,
(1)A、B、C、D四种元素的符号分别是Mg、Na、Cl、C,故答案为:Mg;Na;Cl;C;
(2)C-是氯离子,其离子核外有18个电子,氯离子结构示意图为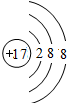 ,故答案为:
,故答案为: ;
;
(3)B是Na,钠和水反应方程式为2Na+2H2O=2NaOH+H2↑;C是氯气、E是氢气,二者反应生成氯化氢,C与E反应的化学方程式H2+Cl2
2HCl,故答案为:2Na+2H2O=2NaOH+H2↑;H2+Cl2
2HCl;
(4)D与E以原子个数为1:4形成的化合物的化学式是CH4 ,其中化学键的类型是极性共价键,故答案为:CH4 ;极性.
B元素原子核外M层电子数目比K层少1个,则B元素是Na元素;
C-比A元素的离子多1个电子层,则C是Cl元素;
D元素的原子核外L层比K层多2个电子,则D元素是C元素;
E元素的原子核外只有一个电子,则E是H元素,
(1)A、B、C、D四种元素的符号分别是Mg、Na、Cl、C,故答案为:Mg;Na;Cl;C;
(2)C-是氯离子,其离子核外有18个电子,氯离子结构示意图为
 ,故答案为:
,故答案为: ;
;(3)B是Na,钠和水反应方程式为2Na+2H2O=2NaOH+H2↑;C是氯气、E是氢气,二者反应生成氯化氢,C与E反应的化学方程式H2+Cl2
| ||
| ||
(4)D与E以原子个数为1:4形成的化合物的化学式是CH4 ,其中化学键的类型是极性共价键,故答案为:CH4 ;极性.
点评:本题考查了原子结构和元素性质,根据原子结构确定元素,知道原子核外电子排布是解本题关键,再结合物质的性质、物质结构等知识点分析解答,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
下列说法正确的是( )
| A、从明矾是常用的净水剂可推测凡含有铝元素的物质都有净水作用 |
| B、不同物质各有其特性,明矾可用做净水剂,Al2(SO4)3就不一定有净水作用 |
| C、净水剂就是指能杀灭水中细菌和有害微生物的化学试剂 |
| D、从理论上说,铝盐和铁盐都可用做净水剂 |
下列方程式的书写符合要求的是( )
| A、碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?H3O++CO32- |
| B、足量乙酸与碳酸钠反应的离子方程式:2H++CO32-═CO2↑+H2O |
| C、铁吸氧腐蚀的正极反应:2H2O+O2+4e-═4OH- |
| D、H2SO3的电离方程式H2SO3?2H++SO32- |
COCl2俗名称作光气,是有毒气体.在一定条件下,可发生的化学反应为:COCl2(g)?CO(g)+Cl2(g)△H<0;下列有关说法不正确的是( )
| A、在一定条件下,使用催化剂能加快反应速率 |
| B、当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变 |
| C、单位时间内生成CO和消耗Cl2的物质的量比为1:1时,反应达到平衡状态 |
| D、平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |



 (1)元素的第一电离能:Al
(1)元素的第一电离能:Al 元素X的原子最外层电子数是其内层的3倍.元素Y基态原子的3p轨道上有4个电子.元素Z位于第四周期,ⅡB族.
元素X的原子最外层电子数是其内层的3倍.元素Y基态原子的3p轨道上有4个电子.元素Z位于第四周期,ⅡB族.