题目内容
6.在一定条件下,氢气和丙烷完全燃烧的热化学方程式分别为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1.5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则氢气和丙烷的体积比为( )| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 1:1 |
分析 先根据方程式求出H2和C3H8的燃烧热,设H2的物质的量为nmol,则C3H8的物质的量为5mol-n,根据放出的热量列方程式解答.
解答 解:设混合气中H2的物质的量为n,则C3H8的物质的量为5mol-n,由热化学方程式可知1mol氢气燃烧放出的热量为285.8kJ,
根据题意,列方程为:285.8kJ/mol×n+2220.0kJ/mol×(5mol-n)=3847kJ,
解得:n=3.75mol,
C3H8的物质的量为5mol-3.75mol=1.25mol,
所以混合气体中H2与C3H8的体积比即物质的量之比为3.75 mol:1.25 mol=3:1,
故选:B.
点评 本题以热化学反应方程式为载体考查根据方程式计算,侧重考查学生分析问题、计算能力,熟练掌握基本公式并灵活运用,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
17.下列有关焰色反应的叙述正确的是( )
| A. | 氯化钠在火焰上灼烧时使火焰呈黄色,是因为氯化钠发生了分解反应 | |
| B. | 用焰色反应可以鉴别KCl和KNO3 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有K元素,可能有Na元素 |
14.Cu与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图表示:下列有关判断正确的是( )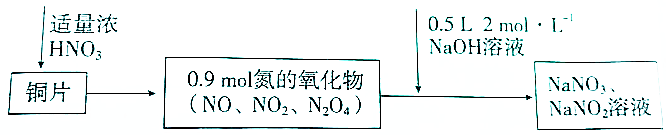

| A. | 若铜片为51.2g.则生成0.2molNaNO3 | |
| B. | 常温下,Cu遇浓硝酸发生钝化.不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16L | |
| D. | 反应过程中生成的Cu(N03)2既是氧化产物,也是还原产物 |
1.某混合物含有氯化钠、碳酸钠和氯化钾.经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为( )
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
4.某同学学习过元素周期律、元素周期表后,为了探究同主族元素性质的递变规律,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该同学完成实验报告.
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1)试管;(2)胶头滴管.(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
Ⅳ.实验结论:(3)Cl>Br>I.
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)原子半径越大得电子能力越弱
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5)分别于氢气反应,F2更容易.
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1)试管;(2)胶头滴管.(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)原子半径越大得电子能力越弱
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5)分别于氢气反应,F2更容易.
11.某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.
(1)【提出假设】假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强;假设3:Fe2+和I-的还原性一样强.
【验证假设】
(2)利用以下装置进行试验
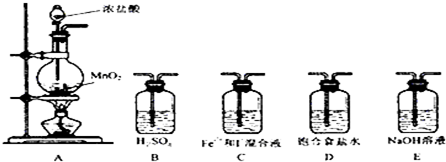
实验必需的装置是:A→C→E(按氯气流向的顺序用序号书写)
(3)实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,不能(能或不能)判断反应的先后顺序.
(4)请在表中填写实验步骤及预期现象与结论.
(5)该实验成功的关键是控制各反应物的用量.该小组称量1.52gFeSO4(M=152g/mol)和1.66gKI(M=166g/mol)固体溶于水中,为了验证上述假设,通入的氯气的体积最多不能超过0.112L.(标准状况)
(6)有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小.并不能证明Fe2+和I-的还原性强弱.于是提出另一验证方案:往KI溶液中滴加FeCl3溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.
(1)【提出假设】假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强;假设3:Fe2+和I-的还原性一样强.
【验证假设】
(2)利用以下装置进行试验

实验必需的装置是:A→C→E(按氯气流向的顺序用序号书写)
(3)实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,不能(能或不能)判断反应的先后顺序.
(4)请在表中填写实验步骤及预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加KSCN; 向B试管中滴加淀粉: | ①若A变红色, B不变色则假设1成立 ②若A不变色, B变蓝色则假设2成立 ③若A变红色, B变蓝色则假设3成立 |
(6)有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小.并不能证明Fe2+和I-的还原性强弱.于是提出另一验证方案:往KI溶液中滴加FeCl3溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.
9.下列说法正确的是( )
| A. | 铝热反应,化学方程式为2Fe+Al2O3═2Al+Fe2O3 | |
| B. | 原电池是电能转化为化学能的装置 | |
| C. | 绿色植物的光合作用则实现了光能向化学能的转化 | |
| D. | 氯碱工业用电解饱和食盐水来制备氯气和火碱就是将化学能转化为电能 |
