题目内容
6. (1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体.
(1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体.①请写出B单质对应元素原子的电子排布式1s22s22p3.
②单质A、F对应的元素以原子个数比1:1形成的气态化合物分子中含3个σ键和2个π键.
③A与B对应的元素形成的10电子分子X的空间构型为三角锥形;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到络离子的化学式为[Cu(NH3)4]2+,其中X与Cu2+之间以配位键结合.
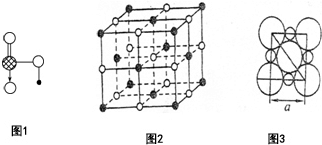
④图1是上述六种元素中的一种元素形成的含氧酸的结构
请简要说明该物质易溶于水的原因:
a.HNO3是极性分子,易溶于极性的水中
b.HNO3分子中的-OH易与水分子之间形成氢键
(2)在NaCl晶体中,阴、阳离子具有或近似具有球型对称结构,它们可以被看作刚性圆球,并彼此“相切”.图2为NaCl的晶胞结构图,图3为晶胞的剖面图:
若a=5.6×10-8cm,则该晶体的密度为2.2g/cm3(精确到小数点后1位.
分析 (1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体,则C、D为金属,根据熔点比较可知,C为Na,D为Cu,其它四种单质根据熔点高低的顺序可知A为H2,B为N2,E为Si,F为C,A与B对应的元素形成的10电子分子X为NH3,图1是上述六种元素中的一种元素形成的含氧酸的结构,则该酸为HNO3,据此答题;
(2)由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的Na+离子处于晶胞的棱上,共有12个.晶胞中Na+离子数目=1+12×$\frac{1}{4}$=4,Cl-离子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量=$\frac{4×58.5}{6.02×10{\;}^{23}}$g,晶胞体积=(5.6×10-8cm)3,据此计算晶胞的密度;
解答 解:(1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体,则C、D为金属,根据熔点比较可知,C为Na,D为Cu,其它四种单质根据熔点高低的顺序可知A为H2,B为N2,E为Si,F为C,A与B对应的元素形成的10电子分子X为NH3,图1是上述六种元素中的一种元素形成的含氧酸的结构,则该酸为HNO3,
①B为N2,B单质对应元素原子的电子排布式为1s22s22p3,
故答案为:1s22s22p3;
②A为H2,F为C,单质A、F对应的元素以原子个数比1:1形成的气态化合物为C2H2,C2H2分子中含3个σ键和2个π键,
故答案为:3;2;
③X为NH3,NH3中氮原子的价层电子对数为$\frac{5+3}{2}$=4,有一对孤电子对,所以NH3空间构型为三角锥形,将NH3溶于水后的溶液滴入到CuSO4溶液中至过量,得到络离子的化学式为[Cu (NH3)4]2+,其中NH3与Cu2+之间以配位键结合,
故答案为:三角锥形;[Cu (NH3)4]2+;配位;
④图1中的含氧酸为HNO3,HNO3易溶于水的原因a.HNO3是极性分子,易溶于极性的水中;b.HNO3分子中的-OH易与水分子之间形成氢键,
故答案为:HNO3是极性分子,易溶于极性的水中;HNO3分子中的-OH易与水分子之间形成氢键;
(2)由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的Na+离子处于晶胞的棱上,共有12个.晶胞中Na+离子数目=1+12×$\frac{1}{4}$=4,Cl-离子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量=$\frac{4×58.5}{6.02×10{\;}^{23}}$g,晶胞体积=(5.6×10-8cm)3,则该晶体的密度为$\frac{4×58.5}{6.02×10{\;}^{23}}$g÷(5.6×10-8cm)3=2.2 g•cm-3,
故答案为:2.2.
点评 本题是对物质结构的考查,涉及电子排布、化学键、分子结构与性质、配合物、晶胞计算等,推断元素是解题关键,注意利用均摊法进行晶胞计算,难度中等,本题侧重考查了学生对知识的综合运用和掌握.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ①③ |
| A. | 互为同位素 | B. | 互为同系物 | C. | 互为同分异构体 | D. | 互为同种物质 |
| A. | 合金都只是由两种或多种金属熔合而成的 | |
| B. | 青铜、黄铜、白铜都是合金 | |
| C. | 合金属于纯净物 | |
| D. | 钢不属于合金 |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理相同 | |
| C. | 为了防止中秋月饼等富脂食品氧化变质,延长保质期,可在包装袋中放入生石灰 | |
| D. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 |
| A. | 常温下干燥的Cl2能用钢瓶贮运 | |
| B. | 检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 | |
| C. | 自然界中不存在游离态硅 | |
| D. | HF溶液不能贮存在磨口玻璃塞的试剂瓶中 |
| A. | Fe2+、Cl-、Na+、NO3- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | Na+、K+、AlO2-、SO42- |
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 标准状况下,22.4L 氖气含有的氖原子数为2 NA | |
| C. | 常温常压下,22.4L CO2气体含有的分子数为NA | |
| D. | 在1L的0.5mol•/L的MgCl2溶液中,含Cl- 数为NA |