题目内容
1.下列对某溶液所含离子检验的叙述正确的是( )| A. | 滴入NaOH溶液,产生白色沉淀,则原溶液一定含有Mg2+ | |
| B. | 滴入BaCl2溶液和稀硝酸,产生白色沉淀,则原溶液一定含有SO42- | |
| C. | 滴入稀硫酸产生无色无味使澄清石灰水浑浊的气体,则原溶液一定含有CO32- | |
| D. | 滴入KSCN溶液呈无色,再通入少量Cl2后呈红色,则原溶液一定含有Fe2+ |
分析 A.滴少量NaOH时生成白色沉淀可能为氢氧化镁、氢氧化铝等;
B.白色沉淀可能为AgCl或硫酸钡;
C.无色无味为二氧化碳;
D.滴入KSCN溶液呈无色,可知不含铁离子,再通入少量Cl2后呈红色,可知亚铁离子被氧化为铁离子.
解答 解:A.滴少量NaOH时生成白色沉淀可能为氢氧化镁、氢氧化铝等,则原溶液可能含有Mg2+,故A错误;
B.白色沉淀可能为AgCl,则原溶液可能含银离子或SO42-,但二者不能同时存在,故B错误;
C.无色气体可能为二氧化碳或二氧化硫,则溶液中可能含有CO32-或HCO3-,或二者都有,故C错误;
D.加入KSCN溶液无色,可知不含铁离子,再通入少量Cl2后呈红色,可知亚铁离子被氧化为铁离子,则该溶液中一定含有Fe2+,故D正确;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意检验时排除干扰离子,题目难度不大.

练习册系列答案
相关题目
11.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品,加入足量水,仍有部分固体未溶解:过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解;
②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在.
该白色粉末可能为( )
①取少量样品,加入足量水,仍有部分固体未溶解:过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解;
②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在.
该白色粉末可能为( )
| A. | Ca(HCO3)2、Al(OH)3 | B. | Al(OH)3、NaHCO3 | C. | Na2SO3、Mg(OH)2 | D. | Na2CO3、CuSO4 |
12.2016年诺贝尔化学奖授予借助某些金属离子制造出复杂新分子,从而合成分子机器的三位科学家,合成新分子过程模拟如下:

下列有关信息错误的是( )

下列有关信息错误的是( )
| A. | 图中新月形分子和环状分子“组合”在一起,铜离子起关键作用 | |
| B. | 利用此方式可以合成新分子,同时也可能创造一种全新“机械键” | |
| C. | 在创造新分子技术中,铜离子是唯一可以借助的金属离子 | |
| D. | 此技术可以“互锁”合成 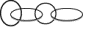 分子,甚至成更复杂的分子 分子,甚至成更复杂的分子 |
10.将C(H+)相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断:
(1)反应所需时间:乙<甲
(2)开始时反应速率:甲>乙
(3)参加反应的锌的质量:甲=乙
(4)整个反应阶段的平均速率:乙>甲
(5)盛盐酸的容器中有锌剩余
(6)盛醋酸的容器中有锌剩余.
以上判断正确的是( )
(1)反应所需时间:乙<甲
(2)开始时反应速率:甲>乙
(3)参加反应的锌的质量:甲=乙
(4)整个反应阶段的平均速率:乙>甲
(5)盛盐酸的容器中有锌剩余
(6)盛醋酸的容器中有锌剩余.
以上判断正确的是( )
| A. | (1)(2)(3)(5) | B. | (1)(3)(5) | C. | (2)(3)(6) | D. | (1)(3)(4)(5) |
11.下列离子方程式中,书写不正确的是( )
| A. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| B. | 纯碱溶液与石灰水反应:Ca2++CO32-=CaCO3↓ | |
| C. | 铜粉与硝酸银溶液反应:Ag++Cu═Ag+Cu2+ | |
| D. | 盐酸滴在石灰石上:CaCO3+2H+=Ca2++CO2↑+H2O |
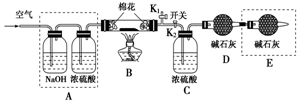 为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x
为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x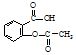 )具有解热镇痛作用(选填“解热镇痛”或“抗菌消炎”),必须密闭干燥存储以防止发生水解,在酸性条件下阿司匹林水解生成乙酸和
)具有解热镇痛作用(选填“解热镇痛”或“抗菌消炎”),必须密闭干燥存储以防止发生水解,在酸性条件下阿司匹林水解生成乙酸和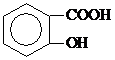 (写出结构简式).
(写出结构简式).