题目内容
11. 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为5ClO2-+4H+=4ClO2↑+Cl-+2H2O;向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快.产生气体速率迅速加快的原因是反应生成的Cl-对反应起催化作用.
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2.用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是H2O2做还原剂时氧化产物为O2,而盐酸则产生大量Cl2.
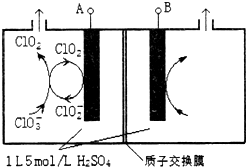
(3)电解法是目前研究最为热门的生产ClO2的方法之一.如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验.
①电源负极为A极(填A或B)
②写出阴极室发生反应的电极反应式和离子方程式ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2-歧化反应.若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为0.8mol/L.
分析 (1)反应物为亚氯酸钠,所在环境为酸性环境,生成物为ClO2气体,且知此反应为歧化反应,据此书写离子反应方程式即可;改加pH相同的硫酸,氢离子浓度不变,应考虑氯离子的影响;
(2)H2O2作还原剂时氧化产物为O2,不会产生环境污染;
(3)①与电源负极相连的一极为阳极,溶液中的阳离子在此电极得到电子,发生还原反应;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2;
③电解池中阴极得到的电子数等于阳极失去的电子数,根据阳极室发生反应:4OH--4e-=O2↑+2H2O,阴极发生:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O分析解答.
解答 解:(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,故化合价由+3价升高到+4价,故部分氯离子降低为-1价,离子反应方程式为:5ClO2-+4H+=4ClO2↑+Cl-+2H2O,反应开始时,溶液中氯离子浓度很小,随着反应的进行,溶液中氯离子浓度增大,反应速率加快,可见氯离子起催化作用,
故答案为:5ClO2-+4H+=4ClO2↑+Cl-+2H2O;反应生成的氯离子对该反应起催化作用;
(2)还可采用盐酸或双氧水还原氯酸钠制备ClO2.用H2O2作还原剂制备ClO2更受欢迎,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2,不会产生环境污染,
故答案为:H2O2做还原剂时氧化产物为O2,而盐酸则产生大量Cl2;
(3)①由图可知,ClO2在电极A上得到1个电子,生成ClO2-,故A应为电源的负极,故答案为:A;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2,离子反应方程式为:ClO3-+ClO2-+2H+=2ClO2↑+H2O,
故答案为:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O;
③在电解池的整个闭合回路中阴极得到的电子数等于阳极失去的电子数,在阳极室发生反应:4OH--4e-=O2↑+2H2O产生1mol的O2,转移4mold电子,阴极室ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O每产生4mol的ClO2电子转移4mol电子,共产生气体5mol.现在两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),产生气体的物质的量为1mol,所以转移电子0.8mol,在阳极有0.8mol的OH--离子放电.因为溶液的体积为1L,所以此时阳极室与阴极室c(H+)之差为0.8mol/L,
故答案为:0.8mol/L.
点评 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.

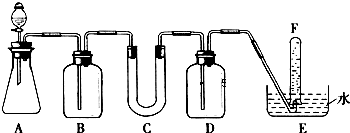
(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
在此反应中,过氧化钠的作用是③(填序号) ①氧化剂;②还原剂;③既是氧化剂又是还原剂;④既不是氧化剂,又不是还原剂.
(4)试管F中收集满气体后,下一步实验操作是:把E中的导管移出水面,关闭分液漏斗的活塞,用拇指堵住试管口,取出试管,立即用带火星的木条伸到试管F的管口,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂.
| A. | 蒸发结晶时应将溶液恰好蒸干便停止加热 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 分液时,分液漏斗下层液体必须从下口放出,上层液体从上口倒出 | |
| D. | 称量时,称量物可放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |

 .
.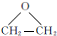 ,能发生银镜反应的F的同分异构体是CH3CHO.
,能发生银镜反应的F的同分异构体是CH3CHO.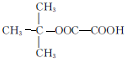 (写结构简式).
(写结构简式). 的合成路线.
的合成路线.
 等二次污染物.
等二次污染物. 磷元素在生产和生活中有广泛的应用.
磷元素在生产和生活中有广泛的应用.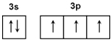 .
.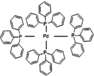 ):P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为sp3;判断该物质在水中溶解度并加以解释不易溶于水.水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶.该物质可用于如图所示物质A(
):P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为sp3;判断该物质在水中溶解度并加以解释不易溶于水.水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶.该物质可用于如图所示物质A(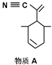 )的合成:物质A中碳原子杂化轨道类型为sp、sp2、sp3;一个A分子中手性碳原子数目为3.
)的合成:物质A中碳原子杂化轨道类型为sp、sp2、sp3;一个A分子中手性碳原子数目为3.