题目内容
工业上用含有Cr2O72-和CrO42-的废水回收铬.其工艺流程如图:
已知:①2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O;
②常温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Cr(OH)3]=1.0×10-32;
③当离子浓度小于1.0×10-5 mol?L-1时,认为沉淀完全.
(1)酸化后的溶液A显 色.
(2)下列选项中,能说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O达到平衡状态的是 (填选项字母);
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-)c.溶液的颜色不变d.溶液的pH不变
(3)为防止FeSO4溶液变质,在保存时需加入的试剂为 (填试剂名称).
(4)过滤操作中需要用到的玻璃仪器有 .
(5)FeSO4溶液与溶液A发生反应的离子方程式为 .
(6)沉淀C的化学式为 ,pH2的范围为 .

已知:①2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O;
②常温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Cr(OH)3]=1.0×10-32;
③当离子浓度小于1.0×10-5 mol?L-1时,认为沉淀完全.
(1)酸化后的溶液A显
(2)下列选项中,能说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O达到平衡状态的是
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-)c.溶液的颜色不变d.溶液的pH不变
(3)为防止FeSO4溶液变质,在保存时需加入的试剂为
(4)过滤操作中需要用到的玻璃仪器有
(5)FeSO4溶液与溶液A发生反应的离子方程式为
(6)沉淀C的化学式为
考点:金属的回收与环境、资源保护
专题:
分析:含有Cr2O72-和CrO42-的废水经酸化后主要转化为Cr2O72-,Cr2O72-具有强氧化性,加入还原性的亚铁离子,将其还原为Cr3+,然后依据溶度积常数分别调节溶液的pH值,让铁离子和铬离子沉淀出来,据此分析以下个小题即可,
(1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定离子浓度大小和溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡;
(3)防止亚铁离子氧化,还要抑制亚铁离子水解,据此解答即可;
(4)过滤是分离固体与液体的一种方法,依据过滤需要仪器回答即可;
(5)亚铁离子具有还原性,铬酸根具有强氧化性,据此书写离子反应方程式即可;
(6)当离子浓度小于1.0×10-5 mol?L-1时,认为沉淀完全,据此解答即可.
(1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定离子浓度大小和溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡;
(3)防止亚铁离子氧化,还要抑制亚铁离子水解,据此解答即可;
(4)过滤是分离固体与液体的一种方法,依据过滤需要仪器回答即可;
(5)亚铁离子具有还原性,铬酸根具有强氧化性,据此书写离子反应方程式即可;
(6)当离子浓度小于1.0×10-5 mol?L-1时,认为沉淀完全,据此解答即可.
解答:
解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)平衡时各物质的浓度不再改变,即溶液的颜色不再改变和pH不变,故选:c d;
(3)防止亚铁离子氧化,并抑制水解,则配制FeSO4溶液时,需加入少量铁粉和稀硫酸,故答案为:铁粉、硫酸;
(4)过滤是把不溶于液体的固体与液体分离的一种方法,所需仪器有玻璃棒、烧杯、铁架台、漏斗,其中属于玻璃仪器的是玻璃棒、烧杯、漏斗,故答案为:烧杯、漏斗、玻璃棒;
(5)依据分析可知:溶液A含有Cr2O72-,具有强氧化性,能氧化亚铁离子为铁离子,离子反应方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(6)依据分析可知,沉淀C为氢氧化铁,当离子浓度小于1.0×10-5 mol?L-1时,认为沉淀完全,故铬离子完全沉淀时有:1×10-5×c(OH)3=1.0×10-32,解:c(OH)=
=10-9,即pH>5完全沉淀,故答案为:Fe(OH)3;>5.
(2)平衡时各物质的浓度不再改变,即溶液的颜色不再改变和pH不变,故选:c d;
(3)防止亚铁离子氧化,并抑制水解,则配制FeSO4溶液时,需加入少量铁粉和稀硫酸,故答案为:铁粉、硫酸;
(4)过滤是把不溶于液体的固体与液体分离的一种方法,所需仪器有玻璃棒、烧杯、铁架台、漏斗,其中属于玻璃仪器的是玻璃棒、烧杯、漏斗,故答案为:烧杯、漏斗、玻璃棒;
(5)依据分析可知:溶液A含有Cr2O72-,具有强氧化性,能氧化亚铁离子为铁离子,离子反应方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(6)依据分析可知,沉淀C为氢氧化铁,当离子浓度小于1.0×10-5 mol?L-1时,认为沉淀完全,故铬离子完全沉淀时有:1×10-5×c(OH)3=1.0×10-32,解:c(OH)=
| 3 |
| ||
点评:本题主要考查的是金属的回收与资源利用,涉及氧化还原反应、化学反应平衡移动原理、离子反应方程式书写,常见实验操作以及仪器选择等,难度较大.

练习册系列答案
相关题目
已知钡的金属活动性处于钾和钠之间.则下列变化中可能实现的是( )
| A、钡可从氯化钠溶液中置换出金属钠 |
| B、钡可从冷水中置换出氢气 |
| C、钡可从硫酸铜溶液中置换出铜 |
| D、在溶液中Ba2+可氧化金属锌,生成Zn2+ |
下列说法不正确的是( )
A、
| ||||
B、
| ||||
| C、常温常压下,只有一种元素的单质是液态 | ||||
| D、常温常压下,气态单质的分子都是由非金属元素的原子形成的 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、2.3gNa与一定量氧气发生反应,钠无剩余,则转移电子数一定为0.1NA |
| B、常温常压下,100g17%H2O2水溶液中含氧原子总数为NA |
| C、常温常压下,2.24LN2气体分子中所含的共用电子对数目为0.3NA |
| D、5.6Fe分别足量氯气、盐酸反应,转移电子数都是0.2NA |
下列说法正确的是( )
| A、化学反应能够制造新物质,同时也能制造出新的元素 |
| B、煤在空气中强热得到焦炭、煤焦油、焦炉气、粗氨水等产物的过程叫煤的干馏 |
| C、在酿酒的过程中,葡萄糖可通过水解反应生成酒精 |
| D、工业生产玻璃、水泥、冶炼铁均需要用到石灰石为原料 |
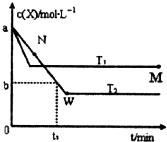 在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A、该反应进行到M点放出的热量大于进行到W点放出的热量 | ||
B、T2下,在0?t1时间内,υ(Y)=
| ||
| C、M点的平衡常数比W点的平衡常数小 | ||
| D、M点时再加入一定量的X,平衡后X的转化率增大 |
下列物质中,不能使酸性KMnO4溶液褪色的物质是( )
① ②乙烯 ③CH3COOH
②乙烯 ③CH3COOH
④CH3CH2OH ⑤CH2═CH-COOH ⑥
①
 ②乙烯 ③CH3COOH
②乙烯 ③CH3COOH④CH3CH2OH ⑤CH2═CH-COOH ⑥

| A、①⑤ | B、①②④⑥ |
| C、①④ | D、①③⑥ |
