题目内容
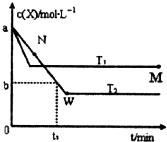 在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A、该反应进行到M点放出的热量大于进行到W点放出的热量 | ||
B、T2下,在0?t1时间内,υ(Y)=
| ||
| C、M点的平衡常数比W点的平衡常数小 | ||
| D、M点时再加入一定量的X,平衡后X的转化率增大 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,
A、根据图象判断参加反应的X的量的多少,反应的X越多,放热越多;
B、根据图中X的浓度变化求出Y的浓度变化,再求反应速率;
C、温度越高反应速率越大,反应是放热反应,升温平衡正向进行;
D、M点时再加入一定量X,达到的新平衡与原平衡比较,根据压强对平衡的影响分析
A、根据图象判断参加反应的X的量的多少,反应的X越多,放热越多;
B、根据图中X的浓度变化求出Y的浓度变化,再求反应速率;
C、温度越高反应速率越大,反应是放热反应,升温平衡正向进行;
D、M点时再加入一定量X,达到的新平衡与原平衡比较,根据压强对平衡的影响分析
解答:
解:由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,
A、进行到M点X的转化率较低,由于正向是放热反应,所以反应进行到M点放出的热量少,故A错误.
B、T2下,在0~t1时间内,X的浓度变化为:c(X)=(a-b)mol/L,则Y的浓度变化为c(Y)=
c(X)=
mol/L,所以v(Y)=
mol?L-1?min-1,故B错误;
C、温度越高反应速率越大,已知T1>T2,温度越高平衡逆向进行,M点的平衡常数比W点的平衡常数小,故C正确;
D、M点时再加入一定量X,达到的新平衡与原平衡比较,平衡正移,但X的转化率减小,所以M点时再加入一定量X,平衡后X的转化率减小,故D错误;
故选:C.
A、进行到M点X的转化率较低,由于正向是放热反应,所以反应进行到M点放出的热量少,故A错误.
B、T2下,在0~t1时间内,X的浓度变化为:c(X)=(a-b)mol/L,则Y的浓度变化为c(Y)=
| 1 |
| 2 |
| a-b |
| 2 |
| a-b |
| 2t1 |
C、温度越高反应速率越大,已知T1>T2,温度越高平衡逆向进行,M点的平衡常数比W点的平衡常数小,故C正确;
D、M点时再加入一定量X,达到的新平衡与原平衡比较,平衡正移,但X的转化率减小,所以M点时再加入一定量X,平衡后X的转化率减小,故D错误;
故选:C.
点评:点评:本题考查了化学平衡图象问题、平衡有关计算、外界条件对平衡移动影响等,难度中等,根据图象判断反应为放热反应是解题的关键.注意把握图象中曲线的变化特点,分析外界条件对化学平衡的影响.

练习册系列答案
相关题目
氢能是理想的清洁能源.下列制氢的方法中,最节能的是( )
A、电解水制氢:2H2O
| ||||
B、高温使水分解制氢:2H2O
| ||||
C、太阳光催化分解水制氢:2H2O
| ||||
D、天然气制氢:CH4+H2O
|
M、X、Y、Z、W是原子序数依次递增的五种短周期元素,M是所有元素中原子半径最小的,X的一种单质是自然界中硬度最高的物质,Z、W同主族且能形成多种常见化合物.下列叙述正确的是( )
| A、稳定性:W的氢化物>Z的氢化物,沸点:W的氢化物<Z的氢化物 |
| B、元素X、Y、Z的单质晶体可能属于同种类型的晶体 |
| C、XZ2、X2M2、M2Z2均为直线型的共价化合物 |
| D、由Z和W组成的一种化合物能使酸性高锰酸钾溶液褪色,表明其具有漂白性 |
下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
A、 实验室用乙醇制取乙烯 |
B、 实验室制取乙酸乙酯 |
C、 石油分馏 |
D、 实验室制取硝基苯 |
下列有关实验原理或操作方法正确的是( )
| A、在漂白粉中滴入70%的硫酸,立即产生黄绿色气体,说明硫酸具有还原性 |
| B、实验室从海带中提取单质碘的方法:取样→灼烧→溶解→过滤→萃取 |
| C、燃料电池制作实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果更好 |
| D、润洗滴定管时应从滴定管上口加入润洗溶液,倾斜着转动滴定管使液体润湿内壁,再从上口倒出,重复2-3次 |