题目内容
14.葛根素具有降血压等作用,其结构简式如图,下列有关说法正确的是( )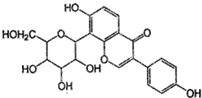
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 一定条件下1mol 该物质与浓溴水反应最多能消耗3mol Br2 | |
| D. | 一定条件下1mol 该物质与H2反应最多能消耗7mol H2 |
分析 有机物含有酚羟基,可发生取代、氧化和显色反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代、消去和氧化反应,且分子中含有羰基,可发生加成反应,结合有机物的结构特点解答.
解答 解:A.含有酚羟基,可发生取代、氧化和显色反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代、消去和氧化反应,故A正确;
B.由结构简式可知有机物的分子式为C21H20O9,故B错误;
C.酚羟基的邻对位的氢可被溴单质取代,共消耗3mol Br2,还有碳碳双键与溴单质发生加成反应,消耗1mol Br2,共4mol Br2,故C错误;
D.分子中能与氢气发生加成反应的有2个苯环、1个羰基和碳碳双键,则1mol该物质一定条件下最多能消耗H2 8mol,故D错误.
故选A.
点评 本题考查有机物的结构和性质,为高频考点和常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,为解答该题的关键,难度中等.

练习册系列答案
相关题目
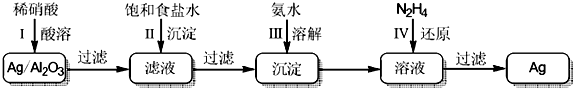
4.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.

实验操作和现象:
(1)现象i 中的白雾是HCl小液滴,形成白雾的原因是FeCl3•6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴.
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
方案1B中溶液变为蓝色
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | iA中部分固体溶解,上方出现白雾 ii稍后,产生黄色气体,管壁附着黄色液滴 iiiB中溶液变蓝 |
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
| 方案1 | B中溶液变为蓝色 |
| 方案2 | B中溶液呈浅橙色;未检出Fe2+ |
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
5.可逆反应在一定条件下达到化学平衡时,下列说法不正确的是( )
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 反应体系中混合物的组成保持不变 | D. | 正、逆反应速率都为零 |
6.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
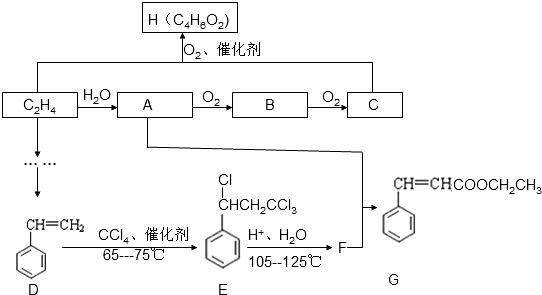
 是G的一种同分异构体
是G的一种同分异构体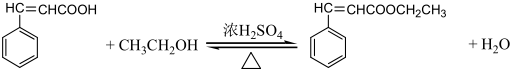 .
.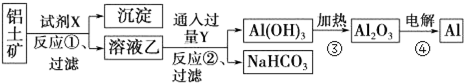
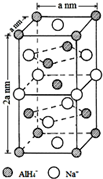 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
. (标明配位键).
(标明配位键).