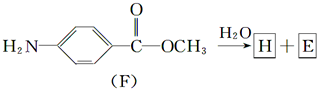题目内容
下列说法正确的是( )
| A、pH=8的溶液一定显碱性 |
| B、某反应,其他条件不变,升高温度使化学平衡常数(K)增大,则此反应为放热反应 |
| C、相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,则c(NH4+)由大到小的顺序是:①>②>③ |
| D、0.1 mol.L-1 的碳酸钠溶液中:c(OH-)=c(H+)-c(HCO3-)+c(H2CO3) |
考点:离子浓度大小的比较,吸热反应和放热反应
专题:
分析:A、溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断,当c(H+)<c(OH-),溶液呈碱性;
B、升高温度,平衡向着吸热反应方向移动;
C、相同系数的铵盐溶液,根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
D、碳酸钠溶液中存在:电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),还存在质子守恒:c(H+)=c(HCO3-)+2c(H2CO3)+c(OH-),据此解答即可.
B、升高温度,平衡向着吸热反应方向移动;
C、相同系数的铵盐溶液,根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
D、碳酸钠溶液中存在:电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),还存在质子守恒:c(H+)=c(HCO3-)+2c(H2CO3)+c(OH-),据此解答即可.
解答:
解:A、溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断,当c(H+)<c(OH-),溶液呈碱性,故A错误;
B、升高温度,平衡向着吸热反应方向移动,若升高温度使化学平衡常数(K)增大,则此反应为吸热反应,故B错误;
C、铵根离子系数都是1,铝离子抑制铵根离子水解,醋酸根离子促进铵根离子水解,故正确顺序为:①>②>③,故C正确;
D、碳酸钠溶液中存在:电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)①,还存在物料守恒:c(Na+)=2[c(HCO3-)+c(H2CO3)]②,联立①②,把c(Na+)消掉即可得到:c(OH-)=c(H+)+c(H2CO3)+(HCO3-)-2c(CO32-),故D错误;故选C.
B、升高温度,平衡向着吸热反应方向移动,若升高温度使化学平衡常数(K)增大,则此反应为吸热反应,故B错误;
C、铵根离子系数都是1,铝离子抑制铵根离子水解,醋酸根离子促进铵根离子水解,故正确顺序为:①>②>③,故C正确;
D、碳酸钠溶液中存在:电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)①,还存在物料守恒:c(Na+)=2[c(HCO3-)+c(H2CO3)]②,联立①②,把c(Na+)消掉即可得到:c(OH-)=c(H+)+c(H2CO3)+(HCO3-)-2c(CO32-),故D错误;故选C.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度定性比较,题目难度中等,能够根据电荷守恒、物料守恒及盐的水解原理判断溶液中各离子浓度大小.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列操作或发生事故时的处理方法正确的是( )
| A、过滤时,用玻璃棒搅动漏斗内液体,使之过滤完全 |
| B、燃着的酒精灯打翻失火,应立即用水浇灭 |
| C、配制一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线 |
| D、浓硫酸不慎溅到皮肤上,应立即用大量水冲洗,最后再涂上3%~5%的小苏打溶液 |
以下四个装置中,你认为用于检验火柴头燃烧可产生SO2的是( )
A、 |
B、 |
C、 |
D、 |
27.4g的Na2CO3与NaHCO3的固体混合物,在空气中加热片刻后称量重25g,将所得的固体混合物溶于200mL、2mol?L-1的稀盐酸恰好完全反应,并完全放出二氧化碳气体,将所得的溶液蒸干、灼烧称量,其质量为( )
| A、11.7g |
| B、23.4 g |
| C、35.1g |
| D、58.5g |
下列说法正确的是( )
| A、金属阳离子只有氧化性 |
| B、金属氧化物一定是碱性氧化物 |
| C、焰色反应是金属元素的一种化学性质 |
| D、22g二氧化碳与标准状况下的11.2L HCl含有相同的分子数 |

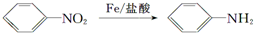 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)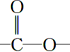 结构.
结构.