��Ŀ����
һ������������������ȼ�գ����û������100ml 3.00mol/L��NaOH��Һ���ܶ�Ϊ1.2g/ml��ǡ����ȫ���գ������Һ�к���NaClO�����ʵ���Ϊ0.05mol����Һ��ֻ��NaCl��NaClO�������ʣ����������й�˵������ȷ���ǣ�������
| A��ԭNaOH��Һ����������Ϊ10.0% |
| B��������Һ��Cl-�����ʵ���Ϊ0.25 mol |
| C����NaOH��Ӧ������Ϊ0.05 mol |
| D�����������Ͳμӷ�Ӧ�����������ʵ���֮��Ϊ3�s1 |
���㣺��ѧ����ʽ���йؼ���,��Һ�����ʵ�������������ؼ���
ר�⣺������
������A������c=
����ԭNaOH��Һ������������
B�������������غ��У�n��NaCl��+n��NaClO��=n��NaOH�����ݴ˼���n��NaCl����
C������Cl2+2NaOH=NaCl+NaClO+H2O������NaOH��Ӧ������Ϊ��
D�����û������ȴ����NaOH��Һǡ����ȫ���գ������Һ�к���NaClO�����ʵ���Ϊ0.05mol��˵��������������Ӧ��������ʣ�࣬��ҺΪ�Ȼ��ƺʹ������ƵĻ��Һ��������Ԫ�ؼ���Ԫ���غ��֪2n��Cl2��=n��Na+��=n��Cl-��+n��ClO-�������ݵ���ת���غ㣬������������������ԭ��Ӧ���ɵ������ӵ����ʵ�������Һ��Cl-��Դ���Ȼ��⼰�������������Ƶķ�Ӧ�����㷴Ӧ�����������Ȼ�������ʵ�����������Ԫ���غ�������������ʵ�����
| 1000��w |
| M |
B�������������غ��У�n��NaCl��+n��NaClO��=n��NaOH�����ݴ˼���n��NaCl����
C������Cl2+2NaOH=NaCl+NaClO+H2O������NaOH��Ӧ������Ϊ��
D�����û������ȴ����NaOH��Һǡ����ȫ���գ������Һ�к���NaClO�����ʵ���Ϊ0.05mol��˵��������������Ӧ��������ʣ�࣬��ҺΪ�Ȼ��ƺʹ������ƵĻ��Һ��������Ԫ�ؼ���Ԫ���غ��֪2n��Cl2��=n��Na+��=n��Cl-��+n��ClO-�������ݵ���ת���غ㣬������������������ԭ��Ӧ���ɵ������ӵ����ʵ�������Һ��Cl-��Դ���Ȼ��⼰�������������Ƶķ�Ӧ�����㷴Ӧ�����������Ȼ�������ʵ�����������Ԫ���غ�������������ʵ�����
���
�⣺A������c=
��֪��ԭNaOH��Һ����������=
��100%=10%����A��ȷ��
B�������������غ��У�n��NaCl��+n��NaClO��=n��NaOH������n��NaCl��=0.1L��3.00mol/L-0.05mol=0.25mol����B��ȷ��
C����Һ�к���NaClO�����ʵ���Ϊ0.05mol������Cl2+2NaOH=NaCl+NaClO+H2O��֪����NaOH��Ӧ������Ϊ0.05mol����C��ȷ��
D����÷�Ӧ����Һ�к�Cl-��ClO-�����ݵ���غ��֪����Һ��n��Na+��=n��Cl-��+n��ClO-��=0.3mol������n��Cl2��=
��0.3mol=0.15mol��
����������Һ��n��ClO-��=0.05mol��������Һ��n��Cl-��=0.3mol-0.05mol=0.25mol��
���������������Ʒ�Ӧ���ɵ������ӵ����ʵ���Ϊxmol�����ݵ���ת���غ���x=0.05mol��
��Һ��Cl-��Դ���Ȼ��⼰�������������Ƶķ�Ӧ�������Ȼ����ṩ��������Ϊ0.25mol-0.05mol=0.2mol��
����Ӧ��Ļ��������n��HCl��=0.2molmol��������Ԫ���غ��֪��n��H2��=
n��HCl��=
��0.2mol=0.1mol���������������Ͳμӷ�Ӧ�����������ʵ���֮��Ϊ0.15mol��0.1mol=3��2����D����
��ѡD��
| 1000��w |
| M |
| 3��40 |
| 1000��1.2 |
B�������������غ��У�n��NaCl��+n��NaClO��=n��NaOH������n��NaCl��=0.1L��3.00mol/L-0.05mol=0.25mol����B��ȷ��
C����Һ�к���NaClO�����ʵ���Ϊ0.05mol������Cl2+2NaOH=NaCl+NaClO+H2O��֪����NaOH��Ӧ������Ϊ0.05mol����C��ȷ��
D����÷�Ӧ����Һ�к�Cl-��ClO-�����ݵ���غ��֪����Һ��n��Na+��=n��Cl-��+n��ClO-��=0.3mol������n��Cl2��=
| 1 |
| 2 |
����������Һ��n��ClO-��=0.05mol��������Һ��n��Cl-��=0.3mol-0.05mol=0.25mol��
���������������Ʒ�Ӧ���ɵ������ӵ����ʵ���Ϊxmol�����ݵ���ת���غ���x=0.05mol��
��Һ��Cl-��Դ���Ȼ��⼰�������������Ƶķ�Ӧ�������Ȼ����ṩ��������Ϊ0.25mol-0.05mol=0.2mol��
����Ӧ��Ļ��������n��HCl��=0.2molmol��������Ԫ���غ��֪��n��H2��=
| 1 |
| 2 |
| 1 |
| 2 |
��ѡD��
���������⿼��������ԭ��Ӧ�ļ��㣬�Ѷ��еȣ��ж���Һ��n��Na+��=n��Cl-��+n��ClO-���ǽ���ؼ���ע��������غ�ĽǶȽ�Ϸ�Ӧ���йط���ʽ���㣮

��ϰ��ϵ�д�
 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
�����Ŀ
���й���Na2O��Na2O2�ıȽ���ȷ���ǣ�������
| A��Na2O��Na2O2�����Ƶ���������Ǽ��������� |
| B��Na2O��Na2O2���Ƕ��ǰ�ɫ���� |
| C��Na2O2�������̼�ķ�Ӧ�У�Na2O2�������������ǻ�ԭ�� |
| D��1mol Na2O2�ں�ˮ�ķ�Ӧ�У�ת�Ƶĵ�����ԼΪ��1.204��1024�� |
���и���Һ�У����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�������
| A��pH=3��H2SO4��Һ�У�c��H+��=10-3mol?L-1 |
| B�������ԵĴ���ʹ����ƵĻ����Һ�У�c��Na+����c��CH3COO-�� |
| C����Na2CO3��Һ�У�2c��Na+��=c��CO32-��+c��HCO3-��+c��H2CO3�� |
| D���Ȼ����Һ�У�c��Cl-����c��NH4+����c��OH-����c��H+�� |
��1.12�����ۼ���25ml 2mol/L��FeCl3��Һ�У���ַ�Ӧ������˵����ȷ���ǣ�������
| A������ʣ�࣬��Һ��dz��ɫ��Cl-���ӵ�Ũ�Ȼ������� |
| B������Һ�еμ���ɫ��KSCN��Һ����Һ��ɫ���� |
| C��Fe2+��Fe3+ �����ʵ���֮��Ϊ6��1 |
| D����������ͻ�ԭ��������ʵ���֮��Ϊ2��5 |
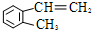 ����һ����Ҫ���л�����ԭ�ϣ�
����һ����Ҫ���л�����ԭ�ϣ� ����������һ�������
����������һ������� 2SO2��g��+O2��g��=2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1molSO2��g������Ϊ1molSO3��g���ġ�H=-99kJ?mol-1����ش��������⣺
2SO2��g��+O2��g��=2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1molSO2��g������Ϊ1molSO3��g���ġ�H=-99kJ?mol-1����ش��������⣺