题目内容
15.由H2、CH4、CO组成的混合物的混合气体a mL,完全燃烧时消耗相同条件下O2的体积也为a mL,则原混合气中CH4的体积分数为( )| A. | $\frac{1}{3}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{2}$ | D. | $\frac{3}{5}$ |
分析 燃烧发生2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,相同体积的氢气、CO消耗氧气体积相等,假设甲烷为y mL,则氢气、CO总体积为(a-y)mL,以此来解答.
解答 解:燃烧发生2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,相同体积的氢气、CO消耗氧气体积相等,假设甲烷为y mL,则氢气、CO总体积为(a-y)mL,
完全燃烧时消耗相同条件下O2的体积也为a mL,则(a-y)×$\frac{1}{2}$+2y=a,解得y=$\frac{a}{3}$L,
则原混合气中CH4的体积分数为$\frac{\frac{a}{3}L}{aL}$=$\frac{1}{3}$,
故选A.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、体积关系为解答的关键,侧重分析与计算能力的考查,注意氢气、CO消耗氧气的体积关系,题目难度不大.

练习册系列答案
相关题目
7.下列化学用语表达正确的是( )
| A. | 乙醇的分子式 C2H5OH | B. | 苯分子的实验式为CH | ||
| C. | 次氯酸的电子式 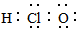 | D. | 乙烯的结构简式 CH2CH2 |
6.下列关于有机物的叙述中正确的是( )
| A. | 甲苯分子中所有原子均在同一个平面上 | |
| B. | 糖类、油脂、蛋白质在酸性条件下均可发生水解反应 | |
| C. | 分子式为C3H8O的有机物在浓硫酸、加热的条件下反应可能得到的有机产物有4种 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
3.下列叙述正确的是( )
| A. | C5H11Cl有8种同分异构体 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| D. | 相同条件下,熔沸点:正丁烷<异丁烷 |
10.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+11.9kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 根据热化学方程式:S( l )+O2( g )?SO2( g )△H=-293.23kJ/mol分析,1mol SO2的键能的总和大于1mol液态硫和1mol氧气的键能之和 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ |
20.工业上,通常采用电解法处理酸性废水中的Cr2O72-,装置示意图如图所示.下列说法正确的是( )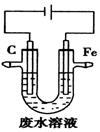

| A. | 石墨极上发生氧化反应 | |
| B. | 阳极的电极反应式为Fe-3e-=Fe3+ | |
| C. | 除去Cr2O72-的反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 随着电解的进行,石墨极附近电解质溶液的pH会减小 |
7.用NA表示阿伏加德罗常数的值,下列有关氯及其化合物的说法正确的是( )
| A. | 7.1gCl2所含电子数为3.4NA | |
| B. | 1molFe与足量Cl2反应,转移的电子数为2NA | |
| C. | 常温常压下,11.2LHCl含有的分子数为0.5NA | |
| D. | 1L1mol/LAlCl3溶液中Cl-的数目为NA |
4.下列关于金属钠的说法中,不正确的是( )
| A. | 钠能从水溶液中置换出铜 | |
| B. | 钠长期置于空气中,最后变成碳酸钠 | |
| C. | 钠和氧气反应,条件不同,产物不同 | |
| D. | 钠与水反应时,钠熔成小球在水面四处游动 |