题目内容
20.已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7.
②HF(aq)═H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
| A. | 298 K时,加蒸馏水稀释HF溶液,$\frac{c({F}^{-})}{c(HF)}$保持不变 | |
| B. | 308 K时,HF的电离常数Ka>3.5×10-4 | |
| C. | 298 K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小 | |
| D. | 2HF(aq)+Ca2+(aq)?CaF2(s)+2H+(aq) K≈0.68 |
分析 A.根据$\frac{c({F}^{-})}{c(HF)}$=$\frac{K}{c({H}^{+})}$判断;
B.升高温度,平衡逆向移动;
C.溶度积只受温度的影响;
D.已知①HF(aq)?H+(aq)+F-(aq),②CaF2(s)?Ca2+(aq)+2F-(aq),将①×2-②可得2HF(aq)+Ca2+(aq)?CaF2(s)+2H+(aq),由此可计算平衡常数.
解答 解:A.因$\frac{c({F}^{-})}{c(HF)}$=$\frac{K}{c({H}^{+})}$,298 K时,加蒸馏水稀释HF溶液,氢离子浓度减小,则$\frac{c({F}^{-})}{c(HF)}$增大,故A错误;
B.298K时K(HF)=3.5×10-4,升高温度,平衡逆向移动,则Ka<3.5×10-4,故B错误;
C.温度不变,则溶度积不变,故C错误;
D.已知①HF(aq)?H+(aq)+F-(aq),②CaF2(s)?Ca2+(aq)+2F-(aq),将①×2-②可得2HF(aq)+Ca2+(aq)?CaF2(s)+2H+(aq),则K=$\frac{(3.5×1{0}^{-4})^{2}}{1.8×1{0}^{-7}}$≈0.68,故D正确.
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算、溶解平衡移动、平衡状态为解答的关键,侧重分析与应用能力的考查,注意K的计算,题目难度不大.

练习册系列答案
相关题目
10.能用键能知识加以解释的是( )
| A. | 稀有气体的化学性质很不活泼 | B. | HF气体比HCl气体沸点高 | ||
| C. | 干冰易升华 | D. | 氮气的化学性质很稳定 |
11. 构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )
构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )
 构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )
构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )| A. | 一段时间后电流计指针将归零,此时可视为反应不再进行 | |
| B. | 当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升 | |
| C. | 当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加 | |
| D. | 实验开始先闭合K2,断开K1,此时NO3-向B电极移动 |
8.化学与生产、生活、社会发展等息息相关,下列说法正确的是( )
| A. | “可燃冰”被认为是21世纪新型洁净的能源,但大量开发和使用会诱发海底地质灾害,还会加重温室效应 | |
| B. | 碘元素被誉为“智力元素”,KI、KIO3、I2都可作碘盐的添加剂 | |
| C. | 硅橡胶无毒无味、耐高温又耐低温,可制成人造心脏,它属于无机非金属材料 | |
| D. | “雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关 |
15.下列项目对应的结论正确的是 ( )
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
| B | C(CH3)4的二氯代物数目(不考虑立体异构) | 2种 |
| C | 除去乙酸乙酯中残留的乙酸 | 可用氢氧化钠溶液 |
| D | 乙醇直接转化为乙酸,油脂水解 | 均属于取代反应 |
| A. | A | B. | B | C. | C | D. | D |
5.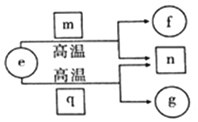 短周期元素X、Y、Z、W的原子序数依次增加,且Y、W为同主族元素.e、f、g分别是元素 Y、X、W的单质;m、n、q分别是由元素X、Y、W与元素Z组成的二元化合物,常温下的 状态依次为液态、气态、固态.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素X、Y、Z、W的原子序数依次增加,且Y、W为同主族元素.e、f、g分别是元素 Y、X、W的单质;m、n、q分别是由元素X、Y、W与元素Z组成的二元化合物,常温下的 状态依次为液态、气态、固态.上述物质的转化关系如图所示.下列说法错误的是( )
 短周期元素X、Y、Z、W的原子序数依次增加,且Y、W为同主族元素.e、f、g分别是元素 Y、X、W的单质;m、n、q分别是由元素X、Y、W与元素Z组成的二元化合物,常温下的 状态依次为液态、气态、固态.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素X、Y、Z、W的原子序数依次增加,且Y、W为同主族元素.e、f、g分别是元素 Y、X、W的单质;m、n、q分别是由元素X、Y、W与元素Z组成的二元化合物,常温下的 状态依次为液态、气态、固态.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径的大小:W>Z>X | |
| B. | 简单氢化物的沸点:W>Y>Z | |
| C. | 元素Y、Z、W形成的单质不止一种 | |
| D. | 元素Y、Z、W与元素X均能形成18e-的分子 |
12.以下有关有机物的应用或说法正确的是( )
| A. | 葡萄糖、蔗糖均可发生银镜反应 | |
| B. | 硫酸铵和乙酸铅均能使蛋白质发生变性 | |
| C. | 乙炔和乙醛均可合成聚合物 | |
| D. | 淀粉和油脂都是能发生水解反应的高分子化合物 |
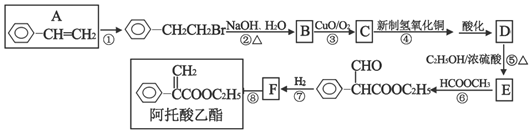
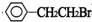 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$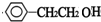 +NaBr.反应③的方程式
+NaBr.反应③的方程式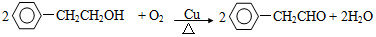 .
.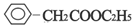 ;
;