题目内容
4.在298K,100kPa时.CH4的燃烧热是890.0kJ/mol,写出该反应的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.0kJ/mol.现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18g液态水,共放出QkJ热量(假定热量未损失),则CH4和CO的物质的量的比为2:1.(2)利用甲烷的燃烧反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液.多孔石墨作电极,在电极上分别通入甲烷和氧气,通入甲烷气体的电极上发生的电极反应是CH4-8e-+10OH-=CO32-+7H2O,当电路中转移12mol电子时,实际提供的电能是890.0kJ,则该电池的能量转化效率是66.7%.
(3)将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置:
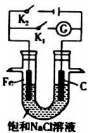
①当开关K1闭合,则铁发生电化学腐蚀中的吸氧腐蚀.
②当开关K2闭合,则总反应的离子方程式为2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+C12↑.
分析 (1)依据热化学方程式书写方法解答,标注物质聚集状态和反应焓变;根据H元素守恒计算CH4的物质的量,进而计算CO的物质的量;
(2)反应中甲烷发生氧化反应,而原电池负极发生氧化反应,应在负极通入甲烷,甲烷在负极失去电子,碱性条件下生成碳酸根与水,根据反应反应方程式计算能量转化率;
(3)①当开关K1闭合,则构成原电池,在中性环境下,金属发生的是吸氧腐蚀;
②当开关K2闭合,则构成电解池,在阳极上发生失电子的氧化反应,在阴极上发生得电子的还原反应,根据电解原理来回答.
解答 解:(1)在298K,100kPa时,CH4的燃烧热是890.0kJ/mol,在298K时,1mol CH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ,则该反应的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;18克液态水的物质的量=$\frac{18g}{18g/mol}$=1mol,根据H原子守恒可知n(CH4)=$\frac{1mol×2}{4}$=0.5mol,故n(CO)=0.75mol-0.5mol=0.25mol,则CH4和CO的物质的量的比为2:1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.0kJ/mol;2:1;
(2)燃料电池中通入燃料的一极为负极,发生氧化反应,通入氧气的一极为正极,发生还原反应,故甲烷在负极失去电子,碱性条件下生成碳酸根与水,电极方程式为CH4-8e-+10OH-=CO32-+7H2O,当有12mol电子转移时,消耗甲烷$\frac{12}{8}$mol,理论上产生热量$\frac{12}{8}$mol×890.0kJ/mol,故能量转化率=$\frac{890.0}{\frac{12}{8}×890.0}×100%$≈66.7%,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;66.7%;
(3)①当开关K1闭合,则构成原电池,在中性环境下,金属发生的是吸氧腐蚀,故答案为:吸氧;
②当开关K2闭合,则构成电解池,铁是阴极,在阳极上氯离子发生失电子的氧化反应,在阴极上氢离子发生得电子的还原反应,总反应式:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+C12↑,
故答案为:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+C12↑.
点评 本题考查热化学方程式书写、原电池与电解池的工作原理,明确电极反应及利用电子守恒、元素守恒等计算是解答本题的关键,难度中等.

| A. | 维生素C中氢的质量分数约为4.5% | |
| B. | 0.352g该试样中氧元素的质量为0.192g | |
| C. | 利用该实验所得数据计算可得维生素C的分子式为C3H4O3 | |
| D. | 维生素C是一种抗氧化剂,俗称抗坏血酸,它在中性或碱性溶液中易被氧化 |
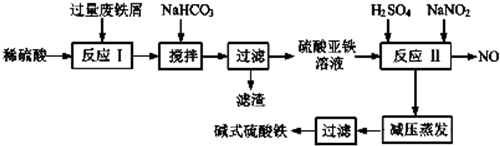
已知部分阳离子以氧氧化物形式沉淀时溶液的pH如下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
(1)加入过量废铁屑的目的是使铁离子充分被还原为亚铁离子,同时防止亚铁离子被空气中氧气氧化(用离子方程式表示);加入少量NaHCO3的目的是Al3++3HCO3-=Al(OH)3↓+3CO2↑;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,该流程中可以循环、回收利用的物质是NO;
(3)生产碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检测所得产品中是否含有Fe2+,应使用的试剂A.(填写字母)
| A.酸性KMnO4溶液 B.KSCN溶液 | C.氯水 D.NaOH溶液. |
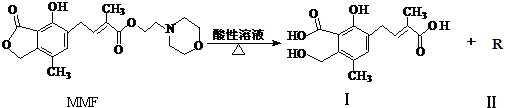
下列说法中正确的是( )
| A. | MMF分子中含有三种官能团 | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物Ⅱ分子中只含碳、氢元素,属于烃类 | |
| D. | 1 mol MMF与足量NaOH 溶液共热,最多可消耗4 mol NaOH |
| A. | 只有①② | B. | 只有②④ | C. | 全部 | D. | 只有①②③ |

 ,其阴、阳离子的个数之比为1:2.
,其阴、阳离子的个数之比为1:2.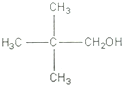
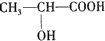 .
.