题目内容
18.在CuCl2溶液中存在如下平衡: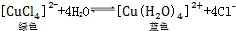 .下列措施:①加锌粉 ②加蒸馏水 ③通入HCl气体 ④浓缩.能使呈蓝色的CuCl2溶液变为绿色的是( )
.下列措施:①加锌粉 ②加蒸馏水 ③通入HCl气体 ④浓缩.能使呈蓝色的CuCl2溶液变为绿色的是( )| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
分析 欲使溶液变成绿色,则平衡向逆反应方向移动,依据影响平衡因素和平衡移动原理分析.
解答 解:欲使溶液变成绿色,则平衡向逆反应方向移动;
①加锌粉,无影响,平衡不移动,故①错误;
②加蒸馏水,平衡正向移动,故②错误;
③通入HCl气体,Cl-的浓度增大,平衡逆向移动,故③正确;
④浓缩,平衡逆向移动,故④正确;
故选D.
点评 本题考查了化学平衡与影响因素分析判断,化学平衡移动原理的分析应用是解题关键,题目较简单.

练习册系列答案
相关题目
8.生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
相关资料
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
实验过程
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示.
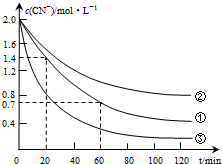
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
相关资料
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
实验过程
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |

(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
6.下列反应的离子方程式正确的是( )
| A. | NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+CO32- | |
| B. | NO2溶于水:3NO2+H2O=2H+$_{\;}^+$+2NO3-+NO | |
| C. | 醋酸溶液与水垢中的Mg(OH)2反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
13.下列分离物质的方法中,根据微粒大小进行分离的是( )
| A. | 萃取 | B. | 渗析 | C. | 蒸馏 | D. | 重结晶 |
3.某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
| A. | H2XO3 | B. | HXO3 | C. | H3XO3 | D. | H2XO4 |
7.用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 改用热的稀硫酸溶液 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
8.常温常压下,下列各组气体不能共存的是( )
| A. | SO2与O2 | B. | CO与O2 | C. | O2与N2 | D. | NO与O2 |
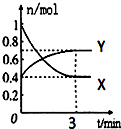 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.