题目内容
13.下列分离物质的方法中,根据微粒大小进行分离的是( )| A. | 萃取 | B. | 渗析 | C. | 蒸馏 | D. | 重结晶 |
分析 渗析中离子、分子可透过半透膜,而胶体不能,与微粒大小有关,以此来解答.
解答 解:A.萃取是利用溶质在不同溶剂中溶解度的不同分离混合物,与溶解度有关,故A不选;
B.渗析中离子、分子可透过半透膜,而胶体不能,与微粒大小有关,故B选;
C.蒸馏利用液体混合物中沸点差异分离,与沸点有关,故C不选;
D.重结晶是利用物质的溶解度随温度的变化较大将其分离的方法,与微粒大小无关,故D不选;
故选B.
点评 本题考查混合物分离、提纯及原理,为高频考点,把握常见混合物分离原理为解答的关键,注意选项D中重结晶为解答的难点,题目难度不大.

练习册系列答案
相关题目
3.某化学课外兴趣小组用实验的方法进行影响化学反应速率的因素.
(1)实验一:已知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑
△H<0,酸性KMnO4溶液和H2C2O4溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快.
①某同学认为酸性KMnO4与H2C2O4溶液反应时反应速率明显加快,是因为反应放热使溶液温度升高.从影响化学反应速率的因素看,你的猜想还可能是催化剂(或锰离子的催化作用)的影响.
②若用实验证明你的猜想,除需要酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是b(填字母序号).
a.K2SO4 b.MnSO4 c.H2O d.MnO2
(2)实验二:探究酸的浓度对MnO2与H2O2反应速率的影响.
已知:MnO2+H2O2+2H+═Mn2++2H2O+O2↑,现取等量的MnO2和下表中的有关物质在相同温度下进行4组实验,分别记录收集等体积氧气所需的时间.
①上表中v1=5.0,v2=5.0.
②有同学提出实验Ⅰ不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是实验Ⅰ中MnO2作催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同.
③若实验测得t2>t3>t4,则可得出的实验结论是酸浓度越大,反应速率越快.
(1)实验一:已知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑
△H<0,酸性KMnO4溶液和H2C2O4溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快.
①某同学认为酸性KMnO4与H2C2O4溶液反应时反应速率明显加快,是因为反应放热使溶液温度升高.从影响化学反应速率的因素看,你的猜想还可能是催化剂(或锰离子的催化作用)的影响.
②若用实验证明你的猜想,除需要酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是b(填字母序号).
a.K2SO4 b.MnSO4 c.H2O d.MnO2
(2)实验二:探究酸的浓度对MnO2与H2O2反应速率的影响.
已知:MnO2+H2O2+2H+═Mn2++2H2O+O2↑,现取等量的MnO2和下表中的有关物质在相同温度下进行4组实验,分别记录收集等体积氧气所需的时间.
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | v1 | v2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | v3 |
| 水的体积/mL | 15 | 14.5 | v4 | 13.5 |
| 所需时间/min | t1 | t2 | t3 | t4 |
②有同学提出实验Ⅰ不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是实验Ⅰ中MnO2作催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同.
③若实验测得t2>t3>t4,则可得出的实验结论是酸浓度越大,反应速率越快.
1.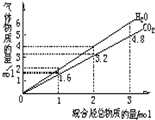 两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )
 两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )| A. | 一定含有甲烷 | B. | 一定含有乙烯 | C. | 一定含有丙炔 | D. | 一定不含乙烯 |
8.某无色透明溶液中,该溶液中一定能够大量共存的离子组是( )
| A. | K+、Na+、MnO4-、NO3- | B. | Fe3+、A13+、Cl-、HS- | ||
| C. | NH4+、AlO2-、Na+、CH3COO- | D. | K+、Na+、SO42-、NO3- |
3.金属阳离子M2+的原子核外电子排布与氖原子相同,则M元素在元素周期表中的位置是( )
| A. | 第二周期第ⅡA族 | B. | 第三周期第ⅢA 族 | C. | 第三周期第ⅡA 族 | D. | 第二周期第ⅥA族 |
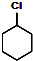 $→_{②}^{NaOH,乙醇,△}$
$→_{②}^{NaOH,乙醇,△}$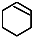 $→_{③}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{④}{→}$
$→_{③}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{④}{→}$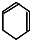
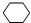 ,B的结构简式是
,B的结构简式是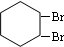 ;
; .
.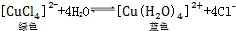 .下列措施:①加锌粉 ②加蒸馏水 ③通入HCl气体 ④浓缩.能使呈蓝色的CuCl2溶液变为绿色的是( )
.下列措施:①加锌粉 ②加蒸馏水 ③通入HCl气体 ④浓缩.能使呈蓝色的CuCl2溶液变为绿色的是( )
 .
.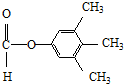 、
、 .
.