题目内容
11.根据海水综合利用的工业流程图(如图),判断下列说法正确的是( )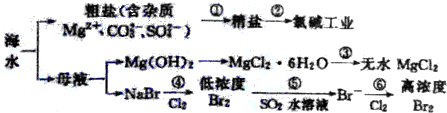
| A. | 过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质 | |
| B. | 在过程③中将MgCl2•6H2O直接灼烧即可制得纯净无水MgCl2 | |
| C. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| D. | 过程⑥所得的高浓度溴水只需分液即可获得液溴 |
分析 海水蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠;母液加氢氧化钠反应生成氢氧化镁沉淀,氢氧化镁和酸反应生成氯化镁,制得氯化镁,母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质得到高浓度的溴,
A.根据粗盐的提纯及电解饱和食盐水产物进行判断;
B.根据镁离子水解及氯化氢的挥发性进行分析;
C.根据反应⑤二氧化硫与溴单质的生成产物进行分析;
D.溴易挥发,应蒸馏分离.
解答 解:A.过程①的提纯中过滤属于物理过程,但是除去镁离子、碳酸根离子、硫酸根离子属于化学过程;过程②电解饱和食盐水获得了氯气和氢气两种单质,故A错误;
B.因MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,若要由MgCl2•6H2O灼烧即可制得无水MgCl2,为防止Mg2+发生水解,应在HCl气氛中进行,故B错误;
C.因Br2+SO2 +2H2O=2HBr+H2SO4,反应后溶液呈酸性,能与金属容器反应,生产中需解决其对设备的腐蚀问题,故C正确;
D.溴易挥发,应蒸馏分离,不能进行分液操作,故D错误;
故选C.
点评 本题考查了海水资源综合利用,为高频考点,涉及了离子的除杂、离子水解、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性,本题难度中等.

练习册系列答案
相关题目
1.第3周期元素R,它的原子核外层上达到饱和所需电子数小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍.则关于R的正确说法是( )
| A. | 常温下,能稳定存在的R的高价氧化物都能与烧碱溶液反应 | |
| B. | R的最高价氧化物对应水化物是强酸 | |
| C. | R和R的氧化物的熔点和硬度都很高 | |
| D. | R能形成稳定的气态氢化物 |
2.能源、环境与人类生活密切相关,研究它们的综合利用有重要意义.
Ⅰ.二甲醚可代替汽油作新型清洁燃料.常温常压下,二氧化碳加氢可选择性生产二甲醚(CH3OCH3)或一氧化碳.已知二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol
(1)写出CO2加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=-259.8kJ•mol-1,该反应的平衡常数的表达式为)
$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$..
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为:3CO+3H2═CH3OCH3+CO2.
(3)二甲醚燃料电池原理如图1所示
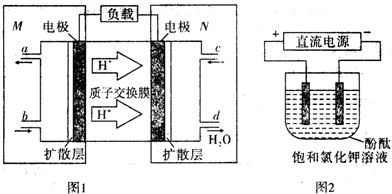
①M区发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗CH3OCH3的质量为0.24g(假设溶液电解前后体积不变,保留2位有效数字).
Ⅱ.硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是bd
a.体系内混合气体的密度保持不变 h.v(NO2)正=v(SO3)逆
c.容器内气体的总压强保持不变 d.NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)?SO3(g)+NO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
①10min后,甲中达到平衡,则甲中反应的平均速率v(NO2)=0.006mol/(L•min).
②丙达到平衡所用的时间<10min(填“<”“>”“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为a=c<b.
Ⅰ.二甲醚可代替汽油作新型清洁燃料.常温常压下,二氧化碳加氢可选择性生产二甲醚(CH3OCH3)或一氧化碳.已知二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol
(1)写出CO2加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=-259.8kJ•mol-1,该反应的平衡常数的表达式为)
$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$..
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为:3CO+3H2═CH3OCH3+CO2.
(3)二甲醚燃料电池原理如图1所示

①M区发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗CH3OCH3的质量为0.24g(假设溶液电解前后体积不变,保留2位有效数字).
Ⅱ.硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是bd
a.体系内混合气体的密度保持不变 h.v(NO2)正=v(SO3)逆
c.容器内气体的总压强保持不变 d.NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)?SO3(g)+NO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
②丙达到平衡所用的时间<10min(填“<”“>”“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为a=c<b.
19.在酸性溶液中,下列各组离子可能共存的是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、NO3-、HCO3- | ||
| C. | SO42-、Fe3+、K+、Cl- | D. | NO3-、K+、SO32-、Mg2+ |
6.下列说法正确的是( )
| A. | 非自发反应在任何条件下都不能发生 | |
| B. | 冰融化为水的过程中△H<0,△S>0 | |
| C. | 2H2(g)+02(g)=2H2O(l)△H=-572kJ•mol-1此反应在低温时可以自发进行 | |
| D. | 知道了某过程有自发性之后,可预测过程发生完成的快慢 |
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 80mL10mol/L的浓盐酸与足量的MnO2加热反应,产生Cl2分子数约为0.2NA | |
| B. | 一定条件下,将1molN2和3molH2混合,充分反应后转移电子数为6NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 常温常压下,等质量的CO和N2中含有原子数目均为2NA |


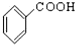
 的名称对氟苯甲醛.
的名称对氟苯甲醛. .
.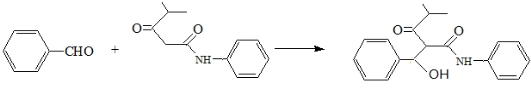 .
.
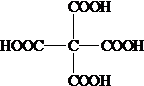 .
.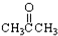 ③CH3CH2Br ④
③CH3CH2Br ④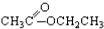 ⑤
⑤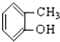 ⑥
⑥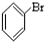 ⑦
⑦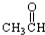 ⑧
⑧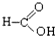 ⑨
⑨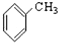 ⑩
⑩