题目内容
14.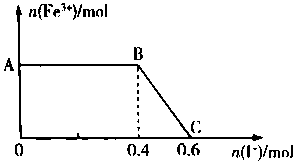 将FeC12溶液与过量氯水(视溶质为Cl2)混合,发生反应:Cl2+ZFeCl2=2FeCl3,得到溶液X.向溶液X中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.已知Cl2、FeCl3均可将I-氧化为I2,其自身分别被还原为Cl-、Fe2+.回答下列问题:
将FeC12溶液与过量氯水(视溶质为Cl2)混合,发生反应:Cl2+ZFeCl2=2FeCl3,得到溶液X.向溶液X中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.已知Cl2、FeCl3均可将I-氧化为I2,其自身分别被还原为Cl-、Fe2+.回答下列问题:(1)I2、Cl2、FeCl3三种物质的氧化性由强到弱的顺序是Cl2、FeCl3、I2.
(2)写出AB 段发生反应的化学方程式:Cl2+2KI=2KCl+12.
(3)写出BC 段发生反应的离子方程式:2Fe3++2I-=2Fe2++I2.
(4)若化学方程式中各物质的化学计量数之比等于其物质的量之比,则可计算出氯水中Cl2的物质的量共有0.3mol.
分析 (1)氯气强氧化性比碘强,可与KI发生氧化还原反应生成I2,结合氧化还原反应中氧化剂氧化性大于氧化产物的氧化性判断物质的氧化性强弱,以此解答;
(2)AB 段发生的反应为氯气和碘化钾反应生成碘单质和氯化钾;
(3)BC 段发生的反应为氯化铁和碘化钾反应生成碘单质和氯化亚铁;
(4)据Cl2+ZFeCl2=2FeCl3,Cl2+2KI=2KCl+12中的量进行计算.
解答 解:(1)氧化还原反应中氧化剂氧化性大于氧化产物的氧化性,Fe3+、I2、Cl2的氯化性由强到弱的顺序为Cl2,FeCl3,I2,故答案为:Cl2、FeCl3、I2;
(2)AB 段发生的反应为氯气和碘化钾反应生成碘单质和氯化钾,故方程式为Cl2+2KI=2KCl+12,故答案为:Cl2+2KI=2KCl+12;
(3)BC 段发生的反应为氯化铁和碘化钾反应生成碘单质和氯化亚铁,故离子方程式为2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(4)Cl2+2KI=2KCl+12
1 2
0.2 0.4
2Fe3++2I-=2Fe2++I2
2 2
0.2 0.2
Cl2+2FeCl2=2FeCl3
1 2
0.1 0.2
故n(Cl2)=0.2mol+0.1mol=0.3mol,故答案为:0.3.
点评 本题以氯气、铁离子的转化为载体综合考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,本题题目难度中等.

练习册系列答案
相关题目
4.镍氢电池已经成为混合动力汽车的主要电池类型.该电池放电时的总反应为:NiOOH+MH═Ni(OH)2+M,其中M表示储氢合金,MH表示吸附了氢原子的储氢合金,下列说法正确的是( )
| A. | 放电时负极反应为:MH+OH--e-═M+H2O | |
| B. | 放电时,每转移1mol电子,有1mol NiOOH被氧化 | |
| C. | 充电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| D. | 电池电解液可用KOH溶液,充电过程中KOH浓度减小 |
5.用滴有酚酞和氯化钠溶液湿润的滤纸分别做甲、乙两个实验,下列判断错误的是( )

| A. | b极附近有气泡冒出 | B. | d极附近出现红色 | ||
| C. | a、c极上都发生氧化反应 | D. | 甲中铁棒比乙中铁棒更易腐蚀 |
2.下列关于胶体的认识,错误的是( )
| A. | 在溶有1molFe(OH)3胶粒的胶体中,含有多于NA个的Fe(OH)3分子 | |
| B. | 将一束强光通过淀粉溶液,也能产生丁达尔效应 | |
| C. | “雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的知识有关 | |
| D. | 纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体 |
19.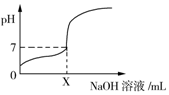 常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
 常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )| A. | X=20 | |
| B. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{{c({A^-})}}$的值减小 | |
| C. | 0.1 mol/L的NaOH溶液中,由水电离出的c(OH-)=0.1 mol/L | |
| D. | 加入NaOH溶液体积为X mL时,溶液中c(A-)=0.05 mol/L |
6.下列关于NO的说法正确的是( )
| A. | 为红棕色气体 | B. | 只有氧化性 | ||
| C. | 是汽车尾气的有害成分之一 | D. | 易溶于水生成硝酸 |
3.设NA为阿伏伽德罗常数的值,下列叙述不正确的是( )
| A. | 含16g氧原子的二氧化硅晶体中含有的δ键数目为2NA | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 12克石墨中含有的共价键数目为1.5NA | |
| D. | 2molSO2和1molO2在一定条件下反应所得混合气体分子数等于2 NA |
4.化学与生活、社会发展息息相关,下列说法正确的是( )
| A. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| B. | 用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理 | |
| C. | “丹砂(HgS)烧之成水银,积变又成丹砂.”这个过程是可逆反应 | |
| D. | 丁达尔效应可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔效应 |
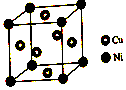 (1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液