题目内容
合成氨然后再生产尿素是最重要的化工生产.
Ⅰ.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)= .
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示).
(3)分析上表数据,下列关系正确的是 (填序号):
a.2c1>1.5mol/L b.2ρ1=ρ2 c.ω3=ω1
Ⅱ.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)?H2NCOONH4(l)(氨基甲酸铵)△H1
第二步:H2NCOONH4(l)?H2O(l)+H2NCONH2(l)△H2
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图Ⅰ所示:
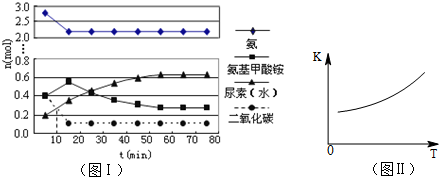
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定.
②第二步反应的平衡常数K随温度T的变化如图Ⅱ所示,则△H2 0.
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2.
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O该反应中的氧化剂为 (写化学式).
②已知:N2(g)+O2(g)=2NO(g)△H=a kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H2=b kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=c kJ?mol-1
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)△H kJ?mol-1.
Ⅰ.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)
| 高温、高压 |
| 催化剂 |
容器 |
甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol?L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度/g?L-1 | ρ1 | ρ2 |
(2)在该温度下甲容器中反应的平衡常数K=
(3)分析上表数据,下列关系正确的是
a.2c1>1.5mol/L b.2ρ1=ρ2 c.ω3=ω1
Ⅱ.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)?H2NCOONH4(l)(氨基甲酸铵)△H1
第二步:H2NCOONH4(l)?H2O(l)+H2NCONH2(l)△H2
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图Ⅰ所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第
②第二步反应的平衡常数K随温度T的变化如图Ⅱ所示,则△H2
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2.
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O该反应中的氧化剂为
②已知:N2(g)+O2(g)=2NO(g)△H=a kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H2=b kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=c kJ?mol-1
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)△H
考点:用盖斯定律进行有关反应热的计算,物质的量或浓度随时间的变化曲线
专题:基本概念与基本理论
分析:(1)先计算出用氮气表示的反应速率,然后利用化学计量数关系计算出用氢气表示的反应速率;
(2)计算出反应前氮气、氢气的物质的量浓度,然后利用化学平衡三段式计算出达到平衡时各组分的浓度,最后根据化学平衡常数表达式计算出该温度下的平衡常数;
(3)先将丙中的数据按照化学计量数转化成反应物氮气、氢气的物质的量,然后利用等效平衡知识进行分析;
(4)①从氨、CO2曲线下降及氨基甲酸铵曲线升高看出第一步是快反应;从尿素曲线升高缓慢看出第二步是慢反应,总反应的快慢由慢的一步决定;
②依据化学平衡常数的表达意义和计算分析判断平衡移动方向;
(5)①根据氧化还原反应反应方程式中氧化剂化合价降低,反应中被还原分析该反应中的氧化剂;
②依据热化学方程式和盖斯定律计算出该反应的焓变.
(2)计算出反应前氮气、氢气的物质的量浓度,然后利用化学平衡三段式计算出达到平衡时各组分的浓度,最后根据化学平衡常数表达式计算出该温度下的平衡常数;
(3)先将丙中的数据按照化学计量数转化成反应物氮气、氢气的物质的量,然后利用等效平衡知识进行分析;
(4)①从氨、CO2曲线下降及氨基甲酸铵曲线升高看出第一步是快反应;从尿素曲线升高缓慢看出第二步是慢反应,总反应的快慢由慢的一步决定;
②依据化学平衡常数的表达意义和计算分析判断平衡移动方向;
(5)①根据氧化还原反应反应方程式中氧化剂化合价降低,反应中被还原分析该反应中的氧化剂;
②依据热化学方程式和盖斯定律计算出该反应的焓变.
解答:
解:(1)容器乙中,反应前氮气的浓度为:
=2mol/L,氮气的平均反应速率为:v(N2)=
=0.1mol?L-1?min-1,根据反应3H2(g)+N2(g)?2NH3(g)可知:v(H2)=3v(N2)=0.3 mol?L-1?min-1,
故答案为:0.3 mol?L-1?min-1;
(2)甲容器中,反应前氢气浓度为:c(H2)=
=1.5mol/L,氮气的浓度为:
=1mol/L,达到平衡时氮气的浓度变化为:(1-c1)mol/L,
由化学平衡的三段式可得:3H2(g)+N2(g)?2NH3(g)
反应前(mol/L):1.5 1 0
浓度变化:(mol/L):3(1-c1) (1-c1) 2(1-c1)
反应后:(mol/L):1.5-3(1-c1) 1-(1-c1) 2(1-c1)
在该温度下甲容器中反应的平衡常数K=
,
故答案为:
;
(3)恒温、恒容条件下:
a.假设乙容器的容积为4L,则达到平衡时甲乙为等效平衡,各组分的含量、浓度相等,此时氮气的浓度为c1,然后将容器的容积缩小到2L,若平衡不移动,2c1=1.5mol/L,由于压强增大,平衡向着正向移动,氨气的浓度增大,所以2c1>1.5mol/L,故a正确;
b.反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据ρ=
可知:2ρ1=ρ2,故b正确;
c.丙中2mol氨气相当于加入了1mol氮气、3mol氢气,而甲中为3mol H2、2mol N2,由于丙反应物氮气的物质的量减小,生成的氨气的物质的量减小,所以ω3<ω1,故c错误;
故选ab;
(4)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二部反应速率慢,所以已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第二步决定,
故答案为:二;
②第二步反应的平衡常数K随温度的升高增大,说明反应是吸热反应,△H2>0,故答案为:>;
(5)①反应CO(NH2)2+NO+NO2=CO2+2N2+2H2O中,化合价升高和降低的都是氮元素,其中NO、NO2中的氮元素化合价降低,被还原,在反应中作氧化剂,
故答案为:NO、NO2;
②已知:①N2(g)+O2(g)=2NO(g)△H=a kJ?mol-1
②N2(g)+3H2(g)=2NH3(g)△H2=b kJ?mol-1
③2H2(g)+O2(g)=2H2O(g)△H=c kJ?mol-1
依据盖斯定律③×3-2×②-2×①得到,4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=(3c-2a-2b)kJ/mol,故答案为:(3c-2a-2b).
| 4mol |
| 2L |
| 2mol/L-1.5mol/L |
| 5min |
故答案为:0.3 mol?L-1?min-1;
(2)甲容器中,反应前氢气浓度为:c(H2)=
| 3mol |
| 2L |
| 2mol |
| 2L |
由化学平衡的三段式可得:3H2(g)+N2(g)?2NH3(g)
反应前(mol/L):1.5 1 0
浓度变化:(mol/L):3(1-c1) (1-c1) 2(1-c1)
反应后:(mol/L):1.5-3(1-c1) 1-(1-c1) 2(1-c1)
在该温度下甲容器中反应的平衡常数K=
| (2-2c1)2 |
| c1?(3c1-1.5) |
故答案为:
| (2-2c1)2 |
| c1?(3c1-1.5) |
(3)恒温、恒容条件下:
a.假设乙容器的容积为4L,则达到平衡时甲乙为等效平衡,各组分的含量、浓度相等,此时氮气的浓度为c1,然后将容器的容积缩小到2L,若平衡不移动,2c1=1.5mol/L,由于压强增大,平衡向着正向移动,氨气的浓度增大,所以2c1>1.5mol/L,故a正确;
b.反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据ρ=
| m |
| V |
c.丙中2mol氨气相当于加入了1mol氮气、3mol氢气,而甲中为3mol H2、2mol N2,由于丙反应物氮气的物质的量减小,生成的氨气的物质的量减小,所以ω3<ω1,故c错误;
故选ab;
(4)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二部反应速率慢,所以已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第二步决定,
故答案为:二;
②第二步反应的平衡常数K随温度的升高增大,说明反应是吸热反应,△H2>0,故答案为:>;
(5)①反应CO(NH2)2+NO+NO2=CO2+2N2+2H2O中,化合价升高和降低的都是氮元素,其中NO、NO2中的氮元素化合价降低,被还原,在反应中作氧化剂,
故答案为:NO、NO2;
②已知:①N2(g)+O2(g)=2NO(g)△H=a kJ?mol-1
②N2(g)+3H2(g)=2NH3(g)△H2=b kJ?mol-1
③2H2(g)+O2(g)=2H2O(g)△H=c kJ?mol-1
依据盖斯定律③×3-2×②-2×①得到,4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=(3c-2a-2b)kJ/mol,故答案为:(3c-2a-2b).
点评:本题考查了化学平衡的影响因素分析、化学反应速率的影响因素判断、化学反应速率的计算等知识,题目难度中等,注意掌握化学平衡的影响因素、化学反应速率的计算方法,能够利用盖斯定律求算反应中的焓变.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1 mol?L-1溴化钠溶液:K+、H+、Cl-、SO42- | ||
| B、由水电离的c(H+)=10-10 mol?L-1的溶液:Na+、Fe2+、NO3-、AlO2- | ||
| C、使酚酞试液变红的溶液:NH4+、Al3+、CO32-、CH3COO- | ||
D、
|
NA为阿伏加德罗常数,下列叙述正确的是( )
| A、0.1 mol Na2O2与足量CO2反应,转移电子数目为0.2 NA | ||
| B、标准状况下,11.2 L SO3所含的分子数目为0.5 NA | ||
C、1 L 1?mol?L-1的Na2CO3溶液中CO
| ||
| D、常温常压下,22.4L N2和NO的混合气体所含的原子数目为2 NA |
设NA代表阿伏伽德罗常数的数值,下列说法正确的是( )
| A、标准状况下,1mol氦气和22.4L氮气所含的原子个数均为2NA |
| B、1molH2O和1molOH-中所含电子数均为10NA |
| C、1molNa2O2中含有的阴离子数为2NA |
| D、铝与足量盐酸反应,生成2.24LH2时,转移的电子数为0.2NA |
下列表达式中,表示复分解反应的是( )
| A、A+B=AB |
| B、AB=A+B |
| C、A+BC=AC+B |
| D、AB+CD=AD+CB |

