题目内容
6.燃烧1g乙炔生成二氧化碳和液态水,放出热量50kJ,则这一反应的热化学反应方程式为( )| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+50 kJ•mol-1 | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(g)△H=-1300 kJ•mol-1 | |
| C. | 2C2H2+5O2═4CO2+2H2O△H=-2 600 kJ | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ•mol-1 |
分析 1mol乙炔的质量为26g,则1mol乙炔完全燃烧生成二氧化碳和液态水,放出的热量为:50kJ×$\frac{26g}{1g}$=1300kJ,则乙炔燃烧的热化学方程式为:C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1300 kJ•mol-1或2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ•mol-1,据此进行解答.
解答 解:1mol乙炔的质量为26g,则1mol乙炔完全燃烧生成二氧化碳和液态水,放出的热量为:50kJ×$\frac{26g}{1g}$=1300kJ,
A.乙炔的燃烧为放热反应,焓变值小于0,且2mol乙炔完全燃烧放出的热量为2600kJ,故A错误;
B.生成水的状态应该为液态,应该标注(l),故B错误;
C.物质状态不同,具有的能量不同,热化学方程式必须标出各物质状态,故C错误;
D.2mol乙炔完全燃烧放出热量为:1300kJ×2=2600kJ,则乙炔燃烧的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ•mol-1,故D正确;
故选D.
点评 本题考查热化学方程式的书写方法,题目难度不大,明确热化学方程式的书写原则为解答关键,注意掌握反应热与焓变的关系,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
16.某一重要烃的衍生物,其结构简式如图所示,下列说法中不正确的是( )
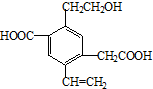

| A. | 该物质在Cu或Ag催化作用下加热,能够被氧化为相应的醛 | |
| B. | 可以用酸性高锰酸钾溶液检验,紫红色褪去,证明其含有碳碳双键 | |
| C. | 1mol该有机物,一定条件下最多可以和4molH2加成 | |
| D. | 该物质消耗Na、NaHCO3、Cu(OH)2的物质的量之比为3:2:1 |
17.在如图所示的8个装置中,属于原电池的是( )


| A. | ②④ | B. | ③④⑤ | C. | ①④⑧ | D. | ②④⑥⑦ |
14.下列类比分析结果正确的是( )
| A. | Fe3O4根据化合价规律可表示为FeO•Fe2O3,则Pb3O4也可表示为PbO•Pb2O3 | |
| B. | CaC2能水解:CaC2+2H2O=Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O=4A1(OH)3↓+3CH4↑ | |
| C. | Cl2与Fe加热生成FeCl3,则I2与Fe加热生成FeI3 | |
| D. | SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |
11.3mol的BaCO3中氧原子的个数( )
| A. | 5.418×1024 | B. | 1.806×1024 | C. | 6.02×1023 | D. | 1.204×1024 |

