题目内容
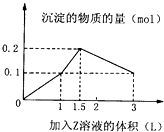 某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )| A、硫酸铝、硫酸铁、氢氧化钠 |
| B、硫酸铝、硫酸镁、氢氧化钠 |
| C、偏铝酸钠、氢氧化钡、硫酸 |
| D、偏铝酸钠、氯化钡、硫酸 |
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:若Z为氢氧化钠溶液,根据图象中沉淀消耗的体积计算分析判断:溶解0.1mol氢氧化铝沉淀消耗的碱的物质的量为0.15mol,不符合题意,
所以z是硫酸溶液,根据图象分析.
所以z是硫酸溶液,根据图象分析.
解答:
解:A.若X、Y、Z分别为硫酸铝、硫酸铁和氢氧化钠,开始滴入氢氧化钠时,Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,沉淀量达到最大,继续滴加氢氧化钠,发生反应:Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)=1:1,而图象表明,溶解0.1mol沉淀,消耗0.15mol,与计量关系不符;故A错误;
B.若X、Y、Z分别为硫酸铝、硫酸镁和氢氧化钠,开始滴入氢氧化钠时,Al3++3OH-=Al(OH)3↓,Mg2++3OH-=Mg(OH)2↓,沉淀量达到最大,继续滴加氢氧化钠,发生反应:Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)=1:1,而图象表明,溶解0.1mol沉淀,消耗0.15mol,与计量关系不符;故B错误;
C.若X、Y、Z分别为偏铝酸钠、氢氧化钡、硫酸,开始滴入硫酸时发生反应:2OH-+2H++Ba2++SO42-=BaSO4↓2H2O,图中第一段直线:0.1molBa(OH)2和硫酸反应,消耗0.1molH2SO4生成沉淀1mol,氢氧化钡消耗完后,继续滴入硫酸,氢离子开始和偏铝酸根离子反应H++AlO2-+H2O=Al(OH)3↓,硫酸的消耗量(硫酸消耗量是氢离子消耗量的一半)和沉淀的生成量是1:2,即0.1molNaAlO2消耗0.05molH2SO4生成沉淀0.1mol;硫酸进一步过量,开始消耗沉淀,Al(OH)3+3H+=Al3++3H2O硫酸和沉淀消耗量应为1.5:1直到把氢氧化铝完全溶解,只剩下不溶于酸的BaSO4,以上三段符合图象的数值变化;故C正确;
D.若X、Y、Z分别为偏铝酸钠、氯化钡、硫酸,滴入硫酸时Ba2++SO42-=BaSO4↓,H++AlO2-+H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,生成最大量沉淀氢氧化铝0.1mol,需要硫酸0.05mol;生成硫酸钡沉淀0.05mol,需要硫酸0.05mol,图中第一段直线不符合,故D错误;
故答案为:C.
B.若X、Y、Z分别为硫酸铝、硫酸镁和氢氧化钠,开始滴入氢氧化钠时,Al3++3OH-=Al(OH)3↓,Mg2++3OH-=Mg(OH)2↓,沉淀量达到最大,继续滴加氢氧化钠,发生反应:Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)=1:1,而图象表明,溶解0.1mol沉淀,消耗0.15mol,与计量关系不符;故B错误;
C.若X、Y、Z分别为偏铝酸钠、氢氧化钡、硫酸,开始滴入硫酸时发生反应:2OH-+2H++Ba2++SO42-=BaSO4↓2H2O,图中第一段直线:0.1molBa(OH)2和硫酸反应,消耗0.1molH2SO4生成沉淀1mol,氢氧化钡消耗完后,继续滴入硫酸,氢离子开始和偏铝酸根离子反应H++AlO2-+H2O=Al(OH)3↓,硫酸的消耗量(硫酸消耗量是氢离子消耗量的一半)和沉淀的生成量是1:2,即0.1molNaAlO2消耗0.05molH2SO4生成沉淀0.1mol;硫酸进一步过量,开始消耗沉淀,Al(OH)3+3H+=Al3++3H2O硫酸和沉淀消耗量应为1.5:1直到把氢氧化铝完全溶解,只剩下不溶于酸的BaSO4,以上三段符合图象的数值变化;故C正确;
D.若X、Y、Z分别为偏铝酸钠、氯化钡、硫酸,滴入硫酸时Ba2++SO42-=BaSO4↓,H++AlO2-+H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,生成最大量沉淀氢氧化铝0.1mol,需要硫酸0.05mol;生成硫酸钡沉淀0.05mol,需要硫酸0.05mol,图中第一段直线不符合,故D错误;
故答案为:C.
点评:本题考查了铝盐、偏铝酸盐和钡盐的等与碱、酸反应的图象分析判断,需要结合物质反应和沉淀生成判断是否与图象中数据相同,题目难度较大.

练习册系列答案
相关题目
下列方法中不能鉴别出NaC1溶液与K2CO3溶液的是( )
| A、滴加稀盐酸 |
| B、滴加Ca(OH)2溶液 |
| C、加热 |
| D、焰色反应 |
NA代表阿伏加德罗常数,下列有关叙述错误的是( )
| A、向FeI2溶液中通入足量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目3NA | ||
| B、1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 | ||
| C、在反应KIO3+6HI=3I2+KI+3H2O中,每生成1mol I2转移电子数为2NA | ||
D、CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为
|
能用于鉴别蛋白质、淀粉和肥皂液的一种试剂是( )
| A、碘水 |
| B、NaOH溶液 |
| C、浓硝酸 |
| D、MgSO4溶液 |
某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等).下列分析推理不正确的是( )
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、15.7g混合物未与盐酸完全反应 |
| D、盐酸的物质的量浓度为3.0mol/L |
 实验室制取乙烯的反应原理为:CH3CH2OH
实验室制取乙烯的反应原理为:CH3CH2OH