题目内容
氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示,请回答下列问题:
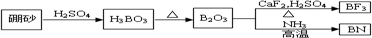
(1)基态B原子的电子排布图为 ;B和N相比,电负性较大的是 ,BN中B元素的化合价为 ;
(2)由B2O3制备BN的化学方程式是 ;
(3)在BF3分子中,F-B-F的键角是 ,B原子的杂化轨道类型为 ,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为 ;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的作用力为 ,层间的作用力为 .

(1)基态B原子的电子排布图为
(2)由B2O3制备BN的化学方程式是
(3)在BF3分子中,F-B-F的键角是
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的作用力为
考点:原子核外电子排布,元素电离能、电负性的含义及应用,键能、键长、键角及其应用,不同晶体的结构微粒及微粒间作用力的区别
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)B的原子序数为5,其基态原子的电子排布式为1s22s22p1根据电子排布式画出电子排布图;
B和N都属于第二周期元素,同周期自左至右元素的电负性逐渐增大,故电负性较大的是N;B属于第ⅢA族元素,化合价为+3价.
(2)由图及元素守恒可写出反应的方程式:B2O3+2NH3
2BN+3H2O;
(3)依据价层电子对互斥理论,计算出的孤对电子对数以及价层电子对数,可判断出分子的空间构型;
(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据其结构与石墨相似,层与层之间应该靠分子间作用力结合.
B和N都属于第二周期元素,同周期自左至右元素的电负性逐渐增大,故电负性较大的是N;B属于第ⅢA族元素,化合价为+3价.
(2)由图及元素守恒可写出反应的方程式:B2O3+2NH3
| ||
(3)依据价层电子对互斥理论,计算出的孤对电子对数以及价层电子对数,可判断出分子的空间构型;
(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据其结构与石墨相似,层与层之间应该靠分子间作用力结合.
解答:
解:(1)基态B原子的电子排布式为1s22s2sp1,其电子排布图为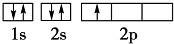 ;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3;
;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3;
故答案为: ;N;+3;
;N;+3;
(2)由图可知B2O3与氨气在高温下反应即生成BN,方程式为B2O3+2NH3
2BN+3H2O;
故答案为:B2O3+2NH3
2BN+3H2O;
(3)依据价层电子对互斥理论,计算出BF3的孤对电子对数=
×(a-xb)=
×(4-4×1)=0,并且价层电子对数为3,所以BF3分子为平面正三角形结构,键角为120°,杂化方式为sp2;BF4-中心原子的孤对电子对数=
×(a-xb)=
×(4-4×1)=0,其价层电子对数为4,所以其结构为正四面体型;
故答案为:120°;sp2;正四面体型;
(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据石墨结构可知六方氮化硼晶体中,层与层之间靠分子间作用力结合.
故答案为:共价键(或极性共价键);分子间作用力.
 ;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3;
;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3;故答案为:
 ;N;+3;
;N;+3;(2)由图可知B2O3与氨气在高温下反应即生成BN,方程式为B2O3+2NH3
| ||
故答案为:B2O3+2NH3
| ||
(3)依据价层电子对互斥理论,计算出BF3的孤对电子对数=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:120°;sp2;正四面体型;
(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据石墨结构可知六方氮化硼晶体中,层与层之间靠分子间作用力结合.
故答案为:共价键(或极性共价键);分子间作用力.
点评:本题考查较为全面,涉及到化学方程式的书写、电子排布图、分子空间构型、杂化类型的判断,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型等方法.

练习册系列答案
相关题目
下列变化过程中,△H<0的是( )
| A、氯化钠溶于水中 |
| B、NH3 (g)和HCl(g)反应生成NH4Cl |
| C、干冰的升华 |
| D、CaCO3 (S)分解为CaO(S)和CO2 (g) |
在城市空气中含有浓度较大的一氧化碳、氮的氧化物等大气污染物,其主要来源是( )
| A、汽车尾气 |
| B、实验室做硝酸实验中排放的废气 |
| C、硫酸工业排放的废气 |
| D、家用液化气不完全燃烧的产生的废气 |
关于原子核外电子排布不正确的是( )
| A、表示一个原子在第三能层上有10个电子应该写成3s23p63d2 |
| B、电子排布1s22s22p7违背了泡利原理 |
| C、基态铁原子的外围电子排布式为4s2 |
| D、基态Si原子的电子排布式为1s22s22p63s23p2 |
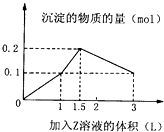 某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )| A、硫酸铝、硫酸铁、氢氧化钠 |
| B、硫酸铝、硫酸镁、氢氧化钠 |
| C、偏铝酸钠、氢氧化钡、硫酸 |
| D、偏铝酸钠、氯化钡、硫酸 |
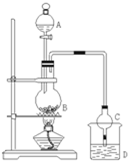 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.