题目内容
18.“北京烤鸭”举世闻名.制作烤鸭套餐的部分原料如下:①鸭肉、②面粉、③黄瓜、④食盐.请回答:(1)富含淀粉的是②(填序号,下同).
(2)富含蛋白质的是①.
(3)富含维生素的是③.
(4)属于调味剂的是④.
分析 (1)面粉富含淀粉;
(2)肉类富含蛋白质;
(3)蔬菜、水果富含维生素;
(4)食盐有咸味.
解答 解:(1)面粉富含淀粉,故答案为:②;
(2)鸭肉富含蛋白质,故答案为:①;
(3)黄瓜富含维生素,故答案为:③;
(4)食盐有咸味,是调味剂,故答案为:④.
点评 本题考查常见的食品添加剂的组成、性质和作用,侧重于常识性内容的考查,难度不大,注意基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)?2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD.
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd.
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-=Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
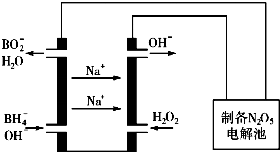
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
4NO2(g)+O2(g)?2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD.
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd.
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-=Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.

9.下列实验装置或操作设计正确且能达到实验目的是( )
| A. |  配制一定物质的量浓度的稀硫酸 | B. |  制取少量的Fe(OH)3胶体 | ||
| C. |  用H2SO4标准溶液滴定NaOH溶液 | D. |  称量NaOH固体 |
6.对于铁与盐酸生成氢气的反应,下列条件下反应速率最快的是( )
| 选项 | 铁的状态 | 盐酸的浓度 | 反应的温度 |
| A | 片状 | 1 mol/L | 20℃ |
| B | 片状 | 3 mol/L | 40℃ |
| C | 粉末 | 1 mol/L | 20℃ |
| D | 粉末 | 3 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
7.学习化学应有辩证的观点和方法.下列说法正确的是( )
| A. | 催化剂不参加化学反应 | B. | 醇和酸反应的产物未必是酯 | ||
| C. | 卤代烃的水解产物一定是醇 | D. | 醇脱水的反应都属于消去反应 |
8.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用pH计测得某稀盐酸的pH为1.54 | |
| C. | 用碱式滴定管量取20.3 mL烧碱溶液 | |
| D. | 用托盘天平称得某物质的质量为13.15g |
