题目内容
12.把AgCl粉末分别放入下列溶液中,平衡时,所得c(Ag+)最小是( )| A. | 0.1mol•L-1MgCl2溶液 | B. | 0.1mol•L-1NH4Cl溶液 | ||
| C. | 0.1mol•L-1KCl溶液 | D. | 0.1mol•L-1 AlCl3溶液 |
分析 AgCl饱和溶液中存在溶解平衡:AgCl(aq)?Ag+(aq)+Cl-(aq),根据溶度积:Ksp=c(Ag+)•c(Cl-),c(Cl-)浓度越大c(Ag+)浓度越小,从平衡移动的角度分析.
解答 解:AgCl饱和溶液中存在溶解平衡:AgCl(aq)?Ag+(aq)+Cl-(aq),根据溶度积:Ksp=c(Ag+)•c(Cl-),c(Cl-)浓度越大c(Ag+)浓度越小,根据题意可知,A中氯离子浓度为0.2mol•L-1,B中氯离子浓度为0.1mol•L-1,C中氯离子浓度为0.1mol•L-1,D中氯离子浓度为0.3mol•L-1,所以银离子浓度最小的为0.1mol•L-1AlCl3溶液,
故选D.
点评 本题考查了沉淀溶解平衡以及平衡移动的相关知识,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
2.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 16 g O2和O3组成的混合气体中含有的原子数为 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
20.下列有关物质应用说法错误的是( )
| A. | 小苏打可以做发酵粉 | |
| B. | 过氧化钠可用于呼吸面具或潜水艇中作为供氧剂 | |
| C. | 铁红常用作红色油漆或涂料 | |
| D. | 钠可以从硫酸铜溶液中置换出铜 |
7.关于Na2CO3与NaHCO3说法正确的是( )
| A. | 等质量的两物质分别与足量盐酸充分反应时,NaHCO3产生CO2气体多 | |
| B. | 可以用澄清石灰水或者氢氧化钠溶液区别 | |
| C. | 等质量的两物质分别与足量的等浓度盐酸反应时,一般是Na2CO3产生CO2气体快 | |
| D. | NaHCO3中Na2CO3混有杂质可以用加热方法除去 |
17.下列相关实验不能达到预期目的是( )
| 相关实验 | 预期目的 | |
| A | 向少量燃尽火柴头的浸泡液中滴加足量稀HNO3、AgNO3 | 验证火柴头含有氯元素 |
| B | 试样加水溶解后,再加入足量Ba(OH)2溶液,有白色沉淀生成 | 检验NaHCO3固体中是否含 Na2CO3 |
| C | 向溶液中加NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝的气体 | 证明原溶液中含有NH4+ |
| D | 两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液 | 探究FeCl3溶液对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
19.在体积均为1.0L的恒容密闭容器中加入足量的相同的炭粉,再 分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )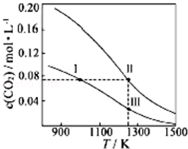

| A. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| B. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| C. | 体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
19.碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )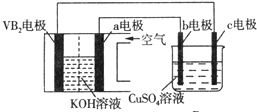

| A. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |

 .
.