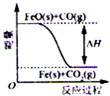
题目内容
19.含3.01×1023个Na+的Na2SO4中约含SO42-0.25mol.分析 根据n=$\frac{N}{{N}_{A}}$计算出钠离子的物质的量,然后结合化合物的组成进行计算.
解答 解:3.01×1023个钠离子的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,由Na2SO4组成可知硫酸根离子的物质的量为钠离子的物质的量的一半,因此硫酸根离子的物质的量为$\frac{1}{2}$×0.5mol=0.25 mol,
故答案为:0.25.
点评 本题考查了物质的量的有关计算,明确阿伏伽德罗常数与物质的量的关系,结合化合物的组成即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列叙述错误的是( )
| A. | 带相反电荷离子之间的静电作用称为离子键 | |
| B. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| C. | 某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键 | |
| D. | 非金属元素形成的化合物中不可能含有离子键 |
10.能使溴水因发生化学反应而褪色,也能使酸性高锰酸钾溶液褪色的是( )
| A. |  | B. | C6H14 | C. | CH3CH2OH | D. |  |
7.甲醇(CH3OH)燃料电池是一种效率高,污染小的电池,该电池在碱性条件下工作时,有关说法错误的是( )
| A. | 甲醇发生氧化反应 | |
| B. | O2在电极上得电子,被还原 | |
| C. | 电池工作时,甲醇电极反应式:CH3OH-6e-+H2O=CO2↑+6H+ | |
| D. | 该电池的甲醇燃料并没有储存在电池内部 |
5.把铁片放入下列溶液中,铁片溶解,并有气体放出的是( )
| A. | 稀硫酸 | B. | CuSO4溶液 | C. | Fe2(SO4)3溶液 | D. | AgNO3溶液 |
9.X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、5、6,则由这三种元素组成的化合物的化学式可能是( )
| A. | XYZ4 | B. | X2YZ4 | C. | X3YZ4 | D. | X4YZ4 |
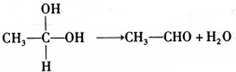 ,
,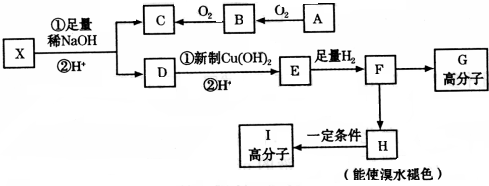
 .
. .
. .
.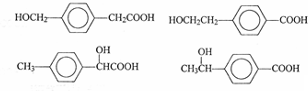 .
.