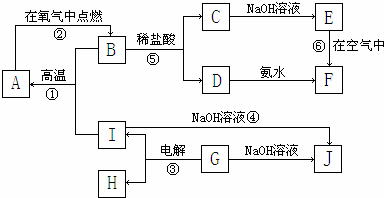
题目内容
14.在标准状况下,将aL NH3完全溶于水得到VmL氨水,溶液的密度为ρg•cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L-1.下列叙述中正确的有( )①若上述溶液中再加入水至所得溶液的质量分数等于0.5ω时,溶质的物质的量浓度小于0.5c;
②c=$\frac{1000a}{22.4V}$
③ω=$\frac{35a}{22.4Vρ}$×100%
④上述溶液中再加入0.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为c(NH4+)>(Cl-)>c(OH-)>c(H+)
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
分析 ①水的密度大于氨水的密度,所以等质量时,水的体积小于氨水的体积,混合后,溶液的体积小于原来的2倍;
②根据C=$\frac{n(溶质)}{V(溶液)}$计算判断;
③根据ω=$\frac{溶质的质量}{溶液的质量}$×100%计算判断;
④根据溶液的酸碱性判断离子浓度大小.
解答 解:①水的密度大于氨水的密度,所以等质量时,水的体积小于氨水的体积,混合后,溶液的体积小于原来的2倍,所以溶质的物质的量浓度大于0.5c,故错误;
②C=$\frac{n(溶质)}{V(溶液)}$=$\frac{\frac{a}{22.4}mol}{V×1{0}^{-3}L}$=$\frac{1000a}{22.4V}$,故正确;
③ω=$\frac{溶质的质量}{溶液的质量}$×100%=$\frac{\frac{a}{22.4}×17}{ρV}$×100%=$\frac{17a}{22.4Vρ}$×100%,故错误;
④加入0.5VmL同浓度稀盐酸,溶液中溶质为氯化铵和氨水,所以溶液呈碱性,溶液中氢氧根离子浓度大于氢离子的浓度,铵根离子的浓度大于氯离子的浓度,所以大小顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故正确.
故选D.
点评 本题考查了物质的量浓度的有关计算,题目难度中等,注意密度比水小的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数小于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半),如氨水、酒精溶液.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
4.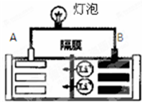 常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )
常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )
 常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )
常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )| A. | 该电池放电时A为负极 | |
| B. | 该电池放电时正极的电极反应式为:Li1-xCoO2+xLi+xe?═LiCoO2 | |
| C. | 该电池充电时阳极质量减轻 | |
| D. | 该电池充电时阴极的电极反应式为:6C+xLi++xe-═LixC6 |
5.萜品醇可作为消毒剂、抗氧化剂、医药和溶剂,其结构简式如图所示.下列说法正确的是( )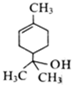

| A. | 萜品醇的分子式为C9H10O | |
| B. | 萜品醇能发生加成反应和取代反应 | |
| C. | 萜品醇能被高锰酸钾被和溴水氧化 | |
| D. | 1mol萜品醇最多与3mol H2发生反应 |
2.关于能源的叙述正确的是( )
| A. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变为热能的过程 | |
| B. | 氢气属于理想的二次能源,可以寻找催化剂使水分解,同时释放能量 | |
| C. | 化石燃料属于一次能源,属于不可再生能源,属于来自太阳的能源 | |
| D. | 大力开发丰富的煤炭资源,将煤进行气化处理提高煤的利用率,可减少对石油的依赖 |
7.下列有机反应中,不属于取代反应的是( )
| A. | ClCH2CH═CH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH═CH2+NaCl | |
| B. | CH2═CHCH3+Cl2→CH2ClCHClCH3 | |
| C. | 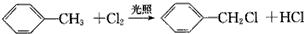 | |
| D. |  |
 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去): .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.