题目内容
1.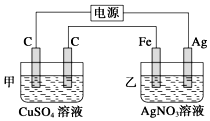 观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g.
观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g.(1)经分析知,甲池是电解池(填“原电池”或“电解池”);乙池中,银电极为阳极(填“阳极”或“阴极”或“正极”或“负极”).
(2)乙池中银电极的电极方程式为Ag-e-=Ag+,根据题目所示数据,电路中转移了0.05mol 电子.
分析 装置是电解池,通电一段时间后发现乙烧杯中铁电极的质量增加了5.4g,则铁做电解池阴极,电极反应为:Ag++e-=Ag;银做阳极,电极反应为:Ag-e-=Ag+,根据铁电极的质量增加了5.4g计算转移电子数.
解答 解:(1)该装置连有电源,所以甲池是电解池,通电一段时间后发现乙烧杯中铁电极的质量增加了5.4g,则铁做电解池阴极,银做阳极,
故答案为:电解池;阳;
(2)乙池中银做阳极,银电极的电极方程式为Ag-e-=Ag+,铁做电解池阴极,电极反应为:Ag++e-=Ag,又铁电极的质量增加了5.4g,所以电路中转移了$\frac{5.4g}{108g/mol}$=0.05mol 电子
故答案为:Ag-e-=Ag+;0.05.
点评 本题考查了电解池原理的应用,主要是电极判断,电极反应,转移电子数的计算等,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
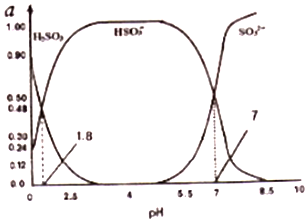
11. 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(2)25℃时,向10mL 0.01mol/LC6H5OH溶液中滴加V mL 0.1mol/L氨水,混合溶液中粒子浓度关系正确的是b(填序号).
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3•H2O)+2c(NH4+)═c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01mol/L C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义.25℃时,Na2CO3第一步水解反应的水解常数Kb=1.78×10-4mol/L.
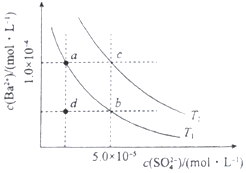
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大).
①T2> 25℃(填“>”、“<”或“=”)
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是bc(填序号).
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
③某课外活动小组为探究BaSO4的溶解度,分子将足量的BaSO4放入:
a.5mL水
b.20mL 0.5mol•L-1的Na2SO4溶液
c.40mL 0.2mol•L-1的Ba(OH)2溶液
d.40mL 0.1mol•L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是A,BaSO4的溶解度的大小顺序为C(填序号).
A.c>a>d>b B.c>a>b>d C.a>d>c>b D.a>c>d>b
④在BaCO3和BaSO4混合物悬浊液中,c(SO42-)与c(CO32-)之比为0.11(或1.1×10-1).
 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K3=2.20×10-13 | - |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | - |
| NH3•H2O | NH3•H2O?OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s)?Ba2++SO42- | - | 1.1×10-10 |
| BaCO3 | BaCO3(s)?Ba2++CO32- | - | 1×10-9 |
(1)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(2)25℃时,向10mL 0.01mol/LC6H5OH溶液中滴加V mL 0.1mol/L氨水,混合溶液中粒子浓度关系正确的是b(填序号).
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3•H2O)+2c(NH4+)═c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01mol/L C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义.25℃时,Na2CO3第一步水解反应的水解常数Kb=1.78×10-4mol/L.
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大).
①T2> 25℃(填“>”、“<”或“=”)
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是bc(填序号).
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
③某课外活动小组为探究BaSO4的溶解度,分子将足量的BaSO4放入:
a.5mL水
b.20mL 0.5mol•L-1的Na2SO4溶液
c.40mL 0.2mol•L-1的Ba(OH)2溶液
d.40mL 0.1mol•L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是A,BaSO4的溶解度的大小顺序为C(填序号).
A.c>a>d>b B.c>a>b>d C.a>d>c>b D.a>c>d>b
④在BaCO3和BaSO4混合物悬浊液中,c(SO42-)与c(CO32-)之比为0.11(或1.1×10-1).
12.下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 将NaHCO3固体加入新制氯水中,有无色气泡(H+) | |
| B. | 新制氯水呈黄绿色(Cl2) | |
| C. | 使蓝色石蕊试纸先变红后褪色(H+、Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
9.下列说法不正确的是( )
| A. | 在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| C. | 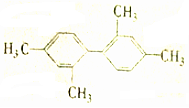 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 聚合物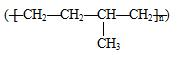 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
16.下列说法正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数 | |
| B. | 对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数 | |
| C. | 升高温度,可以增大活化分子百分数 | |
| D. | 活化分子间的碰撞一定是有效碰撞 |
6.甲烷的燃烧热为△H1,氢气的燃烧热为△H2,且△Hl<△H2,若甲烷和氢气的混合物1mol完全燃烧生成稳定的化合物时,反应热为△H3,则甲烷和氢气的物质的量之比为( )
| A. | $\frac{△{H}_{3-}△{H}_{2}}{△{H}_{3-}△{H}_{2}}$ | B. | $\frac{△{H}_{2-}△{H}_{3}}{△{H}_{3-}△{H}_{1}}$ | ||
| C. | $\frac{△{H}_{2}-△{H}_{3}}{△{H}_{1}-△{H}_{3}}$ | D. | $\frac{△{H}_{3}-△{H}_{1}}{△{H}_{2}-△{H}_{3}}$ |
10.某溶液中有Fe2+、NH4+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中离子数目维持不变的阳离子是( )
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Fe3+ |
11.在一定温度下,向aL密闭的容器中加入1 molX气体和1 molY气体,发生如下反应:X(g)+Y(g)?2Z(g)此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内各物质X、Y、Z的浓度之比为1:1:2 | |
| D. | 单位时间内消耗0.1 molX,同时生成0.2 molZ |