题目内容
在反应 2H2S+SO2=3S↓+2H2O 中,还原剂与氧化剂的物质的量之比为( )
| A、1:2 | B、2:1 |
| C、1:1 | D、3:2 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:氧化还原反应中,含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,借助化学反应来分析实际参加反应的氧化剂与还原剂物质的量之比,在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,H2S中S元素的化合价由-2升高到0,以此来解答.
解答:
解:反应2H2S+SO2═3S+2H2O中,H2S中S元素化合价由-2价升高为0价,H2S是还原剂;
SO2中S元素化合价由+4价降低为0价,SO2是氧化剂;
根据反应中化合价发生变化的S原子数目可知参加反应的H2S全部为还原剂,参加反应的SO2全部为还原剂,所以还原剂与氧化剂的物质的量之比等于化学计量数之比为2:1,
故选B.
SO2中S元素化合价由+4价降低为0价,SO2是氧化剂;
根据反应中化合价发生变化的S原子数目可知参加反应的H2S全部为还原剂,参加反应的SO2全部为还原剂,所以还原剂与氧化剂的物质的量之比等于化学计量数之比为2:1,
故选B.
点评:本题考查氧化还原反应,明确元素的化合价变化是解答本题的关键,并注意氧化剂、还原剂的关系来解答,难度不大.

练习册系列答案
相关题目
5℃时,1mol?L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得各溶液的c(NH4+)分别为a、b、c(单位为mol?L-1),下列判断正确的是( )
| A、a=b=c |
| B、a>b>c |
| C、a>c>b |
| D、c>a>b |
在一定条件下,发生CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应)的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色( )
| A、变深 | B、先变深后变浅 |
| C、不变 | D、变浅 |
常温下,铝与下列酸溶液作用产生氢气的是( )
| A、浓硫酸 | B、稀硝酸 |
| C、浓硝酸 | D、醋酸 |
将一小块钠投入盛有5mL澄清石灰水的试管中,不可能产生的是( )
| A、钠熔成小球并在液面游动 |
| B、有气体产生 |
| C、试管底部有银白色物质产生 |
| D、溶液变浑浊 |
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )


| A、a和b不连接时,铁片上发生的反应为:Cu2++Fe═Cu+Fe2+ |
| B、a和b用导线连接时,Cu2+向铁电极移动 |
| C、a和b分别连接直流电源正、负极,铜片会溶解 |
| D、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
下列变化需要加入适当的氧化剂才能完成的是( )
| A、CuO→Cu |
| B、Fe→FeCl2 |
| C、H2SO4→SO2 |
| D、HNO3→NO2 |
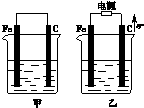 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题: