题目内容
下列变化需要加入适当的氧化剂才能完成的是( )
| A、CuO→Cu |
| B、Fe→FeCl2 |
| C、H2SO4→SO2 |
| D、HNO3→NO2 |
考点:氧化还原反应
专题:
分析:需要加入适当的氧化剂才能实现,说明给予的物质作还原剂,在化学反应中失电子化合价升高,据此分析解答.
解答:
解:需要加入适当的氧化剂才能实现,说明给予的物质作还原剂,在化学反应中失电子化合价升高,
A.CuO→Cu中Cu元素化合价由+2价变为0价,则需要还原剂才能实现,如氢气、CO等,故A错误;
B.Fe→FeCl2中Fe元素化合价由0价变为+2价,所以需要氧化剂才能实现,如稀盐酸,故B正确;
C.H2SO4→SO2中S元素化合价由+6价变为+4价,所以需要加入还原剂才能实现,如Cu、C等,故C错误;
D.该反应中N元素化合价由+5价变为+4价,实际上硝酸分解也能生成二氧化氮,故D错误;
故选B.
A.CuO→Cu中Cu元素化合价由+2价变为0价,则需要还原剂才能实现,如氢气、CO等,故A错误;
B.Fe→FeCl2中Fe元素化合价由0价变为+2价,所以需要氧化剂才能实现,如稀盐酸,故B正确;
C.H2SO4→SO2中S元素化合价由+6价变为+4价,所以需要加入还原剂才能实现,如Cu、C等,故C错误;
D.该反应中N元素化合价由+5价变为+4价,实际上硝酸分解也能生成二氧化氮,故D错误;
故选B.
点评:本题考查氧化还原反应,侧重考查基本概念,熟练掌握常见元素化合价结合概念解答即可,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
在反应 2H2S+SO2=3S↓+2H2O 中,还原剂与氧化剂的物质的量之比为( )
| A、1:2 | B、2:1 |
| C、1:1 | D、3:2 |
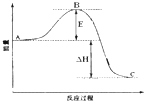 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.下列说法正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.下列说法正确的是( )| A、图中A、C分别表示反应物总能量和生成物总能量 | ||
| B、加入催化剂,图中E和△H都减小 | ||
| C、图中△H=-99kJ?mol-1 | ||
D、SO3(g)?
|
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA |
| B、7 g CnH2n中含有的氢原子数目为NA |
| C、18 g D2O中含有的质子数目为10 NA |
| D、1 L 0.5 mol?L-1Na2CO3溶液中含有的CO32-数目为0.5 NA |
下列离子方程式中,正确的是( )
| A、稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ |
| B、碳酸氢钠溶液与稀盐酸混合:CO32-+2H+═H2O+CO2↑ |
| C、硫酸铜溶液与氢氧化钡混合:Cu2++2OH-═Cu(OH)2↓ |
| D、稀盐酸滴在石灰石上:CaCO3+2H+═H2O+CO2↑+Ca2+ |
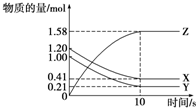 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A、反应开始到10 s,用Z表示的平均反应速率为0.158 mol?L-1?s-1 |
| B、反应开始到10 s,X的物质的量浓度减少了0.79 mol?L-1 |
| C、反应开始到10 s,Y的物质的量浓度减少了0.395 mol?L-1 |
| D、反应的化学方程式为X(g)+Y(g)?Z(g) |
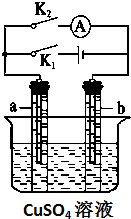 如图所示,某同学按照图装置进行如下实验,请回答下列问题:
如图所示,某同学按照图装置进行如下实验,请回答下列问题: