题目内容
9.已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,M是红褐色沉淀.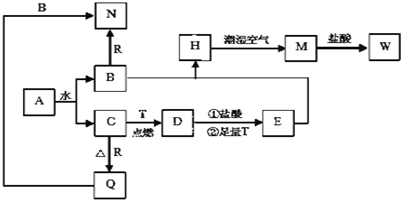
(1)写出下列物质的化学式:A:Na2O2 DFe3O4
(2)H在潮湿空气中变成M的实验现象为白色沉淀迅速变成灰绿色,最终变成红褐色,该过程用化学方程式可表示为:4Fe(OH)2+O2+2H2O=4 Fe(OH)3.
(3)B和R反应生成N的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)实验室储存E溶液中通常加入少量铁屑,原因是Fe+2Fe3+=3Fe2+.(用离子方程式说明).
分析 A为淡黄色固体,且A能和水反应生成无色无味气体C,则A是Na2O2,C是O2、B是NaOH;D是具有磁性的黑色晶体,则D是Fe3O4,金属T在氧气中燃烧生成四氧化三铁,则T是Fe,四氧化三铁与足量的盐酸、足量的Fe反应得到E,E与B(NaOH)反应得到白色沉淀H,则E为FeCl2,H是Fe(OH)2,H在潮湿的空气中得到红褐色沉淀M为Fe(OH)3,M与HCl反应生成W是FeCl3,金属R和氧气反应生成氧化物Q,R与Q都能和NaOH溶液反应生成N,则R是Al、Q是Al2O3、N是NaAlO2,据此解答.
解答 解:A为淡黄色固体,且A能和水反应生成无色无味气体C,则A是Na2O2,C是O2、B是NaOH;D是具有磁性的黑色晶体,则D是Fe3O4,金属T在氧气中燃烧生成四氧化三铁,则T是Fe,四氧化三铁与足量的盐酸、足量的Fe反应得到E,E与B(NaOH)反应得到白色沉淀H,则E为FeCl2,H是Fe(OH)2,H在潮湿的空气中得到红褐色沉淀M为Fe(OH)3,M与HCl反应生成W是FeCl3,金属R和氧气反应生成氧化物Q,R与Q都能和NaOH溶液反应生成N,则R是Al、Q是Al2O3、N是NaAlO2.
(1)通过以上分析知,A是Na2O2,D是Fe3O4,
故答案为:Na2O2;Fe3O4;
(2)H在潮湿空气中变成M的化学方程式:4Fe(OH)2+O2+2H2O=4 Fe(OH)3,反应现象为:白色沉淀迅速变成灰绿色,最终变成红褐色,
故答案为:白色沉淀迅速变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4 Fe(OH)3;
(3)B(NaOH)和R(Al)反应生成N(NaAlO2)的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)实验室储存FeCl2溶液中通常加入少量铁屑,防止亚铁离子被氧化,离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+.
点评 本题考查无机物推断,涉及Na、Al、Fe等元素单质化合物性质与转化,物质的颜色及转化关系中特殊反应是推断突破口,需要学生熟练掌握物质性质,题目难度中等.

| A. | C3H7Cl | B. | C3H8 | C. | C3H6 | D. | C |
①2BrO3-+Cl2═Br2+2ClO3-
②ClO3-+5Cl-+6H+═3Cl2+3H2O
③2FeCl2+Cl2═2FeCl3
④2FeCl3+2KI═2FeCl2+2KCl+I2
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
| A. | CH3CH2CH=CHCH2CH3不存在顺反异构体 | |
| B. | 分子式为C5H10O2的羧酸有8种 | |
| C. | 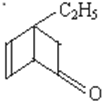 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 | |
| D. | 棱晶烷  为正三棱柱形,它的二氯代物有5种 为正三棱柱形,它的二氯代物有5种 |
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一. 科学家预言,燃料电池将是21世纪获得电能的重要途径,近几年开发甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过,其工作原理的示意图如下:
科学家预言,燃料电池将是21世纪获得电能的重要途径,近几年开发甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过,其工作原理的示意图如下: ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: .
. 分子结构中在同一平面上的碳原子数最多为11个.
分子结构中在同一平面上的碳原子数最多为11个.