题目内容
15.某化学研究性学习小组的同学在学习了NH3的性质时讨论:运用类比的思想,既然NH3具有还原性,能否像H2那样还原CuO呢?他们设计实验制取NH3并探究上述问题.请你参与该小组的活动并完成下列研究:(1)制取NH3
①写出实验制取NH3的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②在实验室中,还可以用浓氨水与NaOH固体(填写一种试剂)快速制取少量NH3;
③有同学模仿排饱和食盐水收集氯气的方法,想用排饱和NH4Cl溶液的方法收集NH3.你认为他能否达到目的?否(填“能”或“否”).
(2)该小组中某同学设计了如图所示的实验装置(夹持未画出),探究NH3的还原性:
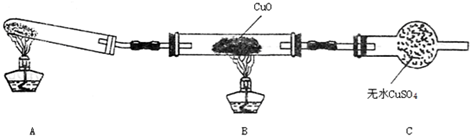
①该装置在设计上有一定缺陷,对该装置的改进措施是:在装置A与B之间增加装有碱石灰的干燥管;C装置之后增加尾气吸收装置.
②利用改进后的装置进行实验,充分反应后,观察到CuO全部变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体.写出NH3与CuO反应的化学方程式3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(3)问题讨论
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+=Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O.取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有.
分析 (1)①实验室用固体氯化铵和熟石灰粉末混合加热制取氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气;
③氨气极易溶于水,氯化铵对氨气的溶解性影响不大;
(2)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,氨气有毒,需要完全吸收装置;
②由题意“CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体”可知生成物为铜、氮气和水,以此书写化学方程式;
(3)在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu与Cu2+.
解答 解:(1)①实验室用氯化铵和消石灰反应生成氨气和氯化钙、水,反应的化学方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气,
故答案为:NaOH固体(或生石灰或碱石灰等);
③氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大,所以不能用用排饱和氯化铵溶液的方法收集氨气,
故答案为:否;
(2)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,氨气有毒,会污染空气,多余的氨气不能直接排放,需要在C装置后需要连接尾气吸收装置,
故答案为:在装置A与B之间增加装有碱石灰的干燥管;C装置之后增加尾气吸收装置;
②CuO变为红色物质,该红色物质为Cu,无水CuSO4变蓝色,说明反应生成水,同时生成一种无污染的气体,根据质量守恒及化合价变化可知该气体为氮气,即:氧化铜与氨气反应生成铜、氮气和水,反应的化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(3)在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu与Cu2+,检验该红色物质中是否含有Cu2O的实验方案为:取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有,
故答案为:取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有.
点评 本题考查氨气的制备方法及化学性质,题目难度中等,明确氨气的性质及实验基本操作方法是解题关键,试题侧重考查学生的分析、理解能力及化学实验能力.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案| A. | C12H20O6 | B. | C15H26O6 | C. | C18H32O6 | D. | C21H38O6 |
 常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液.整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液.整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中 $\frac{c({H}^{+})}{c(O{H}^{-})}$ 减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-) |
| A. | 除去N2中的少量O2:通过灼热的铜网,收集气体 | |
| B. | 除 CO2中的少量HCl:通入饱和Na2CO3溶液,收集气体 | |
| C. | 除去FeCl3溶液中的少量FeCl2:加入足量铁屑,充分反应后过滤 | |
| D. | 除去NaCl溶液中的少量AlCl3:加入适量氨水,过滤 |
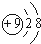 ③NH4+ ④O2-,核外电子总数相同的是( )
③NH4+ ④O2-,核外电子总数相同的是( )| A. | ②③④ | B. | ①②③④ | C. | ①②③ | D. | ①③④ |
 ②Na2O2
②Na2O2 ③N2
③N2 ④H2O
④H2O .
.