题目内容
(1)将质量比为7:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为 ;氮原子和氧原子的个数之比为 ;1mol该混合气体的质量为 ;22克该混合气体在标准状况下的体积为 .
(2)相同质量的Na、Mg、Al分别与足量盐酸充分反应,生成的氢气质量比为 .
(2)相同质量的Na、Mg、Al分别与足量盐酸充分反应,生成的氢气质量比为
考点:化学方程式的有关计算,物质的量的相关计算
专题:计算题
分析:(1)利用n=
计算物质的量及其比值,利用分子构成来计算原子个数比,利用总质量与总物质的量来计算混合气体的平均摩尔质量;
(2)令Na、Mg、Al的质量都为1g,根据n=
计算Na、Mg、Al的物质的量,金属提供电子的物质的量之比等于生成氢气的质量之比.
| m |
| M |
(2)令Na、Mg、Al的质量都为1g,根据n=
| m |
| M |
解答:
解:(1)由质量比为7:15的N2和NO混合,设混合气体中N2和NO的质量分别为28g、60g,
则N2的物质的量为
=1mol,NO的物质的量为
=2mol,
即混合气体中N2和NO的物质的量之比为1mol:2mol=1:2,
氮原子和氧原子的个数比为(1mol×2+2mol×1mol):2mol=2:1,
该混合气体的平均摩尔质量为
=29.3g/mol,即1mol混合气体的质量为:1mol×29.3g/mol=29.3g;
22克该混合气体在标准状况下的体积为:
×22.4L/mol=16.8L,
故答案为:1:2;2:1; 29.3 g; 16.8 L;
(2)令Na、Mg、Al的质量都为1g,则:
1gNa的物质的量为
=
mol,1gNa提供电子物质的量为
mol×1=
mol,
1gMg的物质的量为
=
mol,1gMg提供电子物质的量为
mol×2=
mol,
1gAl的物质的量为
=
mol,1gAl提供电子物质的量为
mol×3=
mol,
金属提供电子的物质的量之比等于生成氢气的质量之比,
mol:
mol:
mol=36:69:92,
故答案为:36:69:92.
则N2的物质的量为
| 28g |
| 28g/mol |
| 60g |
| 30g/mol |
即混合气体中N2和NO的物质的量之比为1mol:2mol=1:2,
氮原子和氧原子的个数比为(1mol×2+2mol×1mol):2mol=2:1,
该混合气体的平均摩尔质量为
| 28g+60g |
| 1mol+2mol |
22克该混合气体在标准状况下的体积为:
| 22 g |
| 29.3g/mol |
故答案为:1:2;2:1; 29.3 g; 16.8 L;
(2)令Na、Mg、Al的质量都为1g,则:
1gNa的物质的量为
| 1g |
| 23g/mol |
| 1 |
| 23 |
| 1 |
| 23 |
| 1 |
| 23 |
1gMg的物质的量为
| 1g |
| 24g/mol |
| 1 |
| 24 |
| 1 |
| 24 |
| 1 |
| 12 |
1gAl的物质的量为
| 1g |
| 27g/mol |
| 1 |
| 27 |
| 1 |
| 27 |
| 1 |
| 9 |
金属提供电子的物质的量之比等于生成氢气的质量之比,
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
故答案为:36:69:92.
点评:本题考查物质的量的简单计算,巧设物质的质量可简化计算,并熟悉质量与物质的量的关系及常见物质的摩尔质量即可计算解答.

练习册系列答案
相关题目
下列事实中能说明亚硝酸是弱电解质的是( )
| A、用HNO2溶液作导电试验,灯光较暗 |
| B、HNO2是共价化合物 |
| C、亚硝酸不与氯化钠反应 |
| D、常温下0.1mol?L-1亚硝酸溶液的c(H+)为7.1×10-3mol?L-1 |
在下列溶液中能大量共存的离子组是( )
| A、Fe3+、Na+、Cl-、SCN- | ||
B、HCO3-、Ca2+、C
| ||
| C、Na+、AlO2-、NO3-、H+ | ||
| D、K+、Na+、Cl-、SO42- |
常温下,有关下列4种溶液的说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol?L-1氨水 | Ph=11 氨水 |
0.1mol?L-1 盐酸 |
pH=3 盐酸 |
| A、由水电离出的c(H+):③>① |
| B、①稀释到原来的100倍,pH与②相同 |
| C、①与③混合,若溶液pH=7,则溶液中c(NH4+)>C(Cl-) |
| D、②与④等体积混合,混合液pH>7 |
 元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题:
元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题:
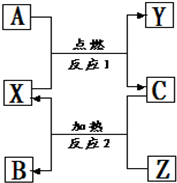 A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:
A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答: