题目内容
18.综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如图所示: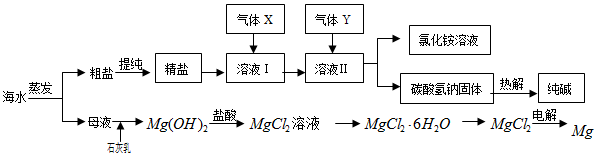
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤过滤;⑥加适量的盐酸;⑦蒸发结晶.(填操作名称)
(2)流程中通入的气体X为NH3,理由是NH3的溶解度大,有利于提高产率.
(3)溶液Ⅱ中发生反应的化学方程式是:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(4)高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体是氧化镁,试写出该反应的化学方程式MgCl2•6H2O $\frac{\underline{\;高温\;}}{\;}$MgO+2HCl↑+5H2O↑.
分析 将海水蒸发浓缩、冷却结晶得到粗盐和母液,向母液中加入Ca(OH)2,发生反应Mg2++2OH-=Mg(OH)2↓,过滤得到Mg(OH)2沉淀,将Mg(OH)2溶于稀盐酸中发生反应Mg(OH)2+2HCl=MgCl2+2H2O,将溶液蒸发浓缩、冷却结晶得到MgCl2.6H2O,将MgCl2.6H2O晶体在HCl氛围中加热得到固体
MgCl2,电解熔融氯化镁得到Mg,发生反应为MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
将粗盐提纯得到NaCl溶液,向溶液中通入氨气和二氧化碳,发生反应NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,碳酸氢钠溶解度小于NaCl而析出,所以得到溶液X为NH4Cl溶液,将NaHCO3加热发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,最后得到碳酸钠固体,
(1)粗盐提纯是通过溶解把不溶物与食盐初步分离、过滤把不溶物彻底除去、蒸发把食盐从溶液中分离出来而得到食盐的过程;
(2)氨气溶解度大,二氧化碳溶解度小,先通入氨气会增大二氧化碳的吸收;
(3)根据碳酸钠的生产进行分析,向饱和食盐水中通入氨气再通入二氧化碳即可生成碳酸氢钠固体,碳酸氢钠受热分解即可得到碳酸钠;
(4)高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体是氧化镁,还有氯化氢和水蒸气,据此书写方程式.
解答 解:(1)将生成的硫酸钡、碳酸钡、碳酸钙、氢氧化镁沉淀从溶液中除去用过滤的方法;氯化钠和盐酸的混合溶液得到氯化钠晶体,可以用蒸发结晶的方法,除去溶液中的氯化氢和水,
故答案为:过滤;蒸发结晶;
(2)相同条件下,氨气的溶解度大于二氧化碳,为了提高二氧化碳的溶解度,先向饱和食盐水中通入氨气,故答案为:NH3;NH3的溶解度大,有利于提高产率;
(3)溶液Ⅱ中为氯化钠和氨水的混合液,为了提高二氧化碳的溶解度,加入二氧化碳后,NaCl、NH3、CO2等发生反应生成NaHCO3和NH4Cl,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(4)从题意看出,高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体只有氧化镁,氯元素、氢元素和氧元素要成为氯化氢和水蒸气释放出去,该反应的化学方程式:MgCl2•6H2O$\frac{\underline{\;高温\;}}{\;}$MgO+2HCl↑+5H2O↑,
故答案为:MgCl2•6H2O$\frac{\underline{\;高温\;}}{\;}$MgO+2HCl↑+5H2O↑.
点评 本题以海水资源综合利用为载体考查了氧化还原反应、物质的分离和提纯、工艺流程等知识点,能从整体上把握工艺流程,知道物质间的反应、每一步的目的,题目难度中等.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 同质量的气体A与气体B,所含分子数目之比为a:b | |
| B. | 气体A与气体B的摩尔质量之比为a:b | |
| C. | 相同条件下,a g气体A与b g气体B体积之比为b:a | |
| D. | 相同条件下,气体A与气体B的密度之比为b:a |
 肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:
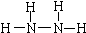 .
.(2)实验室用两种固体制取NH3的反应化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O.
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2+4H2O.
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如表:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)[n(NH3):n(CO2]=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是c(NH3)增大,平衡正向移动.图中A点处,NH3的平衡转化率为42%.
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
①判断乙容器中反应进行的方向是逆向(填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为丙>甲=乙.
(7)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+5O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(8)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g).在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是c(填字母代号).
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(9)如果某氨水的电离程度为1%,浓度为0.01mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3•H2O的浓度为0.002mol/L[已知Ksp[Mg(OH)2]=4.0×10-12].
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 标准状况下,22.4L 甲醇中含有的氧原子数为1NA | |
| C. | 1mol羟基中电子数为10NA | |
| D. | 在30 g甲醛和醋酸的混合物中,含有碳原子数为1NA |
| A. | CH3CH2CH3 | B. | CH3CH2CH2CH3 | C. | CH3COCH2CH3 | D. | 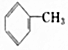 |
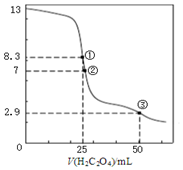 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=0.0500mol•L-1 | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |