题目内容
一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1 mol/L的下列6种溶液的pH:
(1)请根据上述信息判断下列反应不能发生的是 (填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.2HCN+Na2CO3-→2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
(2)己知常温时Ksp(AgCl)=1.8×10-10mol2.L-2,向50mL 0.018mo1.L-l的AgNO3溶液中加入相同体积0.020mol.L-1的盐酸,则c(Ag+)= .
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.2HCN+Na2CO3-→2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
(2)己知常温时Ksp(AgCl)=1.8×10-10mol2.L-2,向50mL 0.018mo1.L-l的AgNO3溶液中加入相同体积0.020mol.L-1的盐酸,则c(Ag+)=
考点:弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,根据强酸生成弱酸的特点判断反应能否进行;
(2)根据溶度积常数计算.
(2)根据溶度积常数计算.
解答:
解:(1)六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,则
A.CH3COOH酸性大于HCN,反应能发生,故A正确;
B.酸性H2CO3>HClO>HCO3-,应生成NaHCO3,反应不能发生,故B错误;
C.酸性H2CO3>HClO>HCN,应生成NaHCO3,不能生成CO2,故C错误;
D.酸性C6H5OH>HCO3-,反应能发生,故D正确;
E.酸性H2CO3>C6H5OH>HCO3-,反应能发生,故E正确,
故答案为:BC;
(2)向50mL 0.018mol?L-1的AgNO3溶液中加入相同体积0.020mol?L-1的盐酸,盐酸过量,反应后的c(Cl-)=
=0.001mol/L,
则c(Ag+)=
=
mol/L=1.8×10-7 mol/L,
故答案为:1.8×10-7 mol/L.
A.CH3COOH酸性大于HCN,反应能发生,故A正确;
B.酸性H2CO3>HClO>HCO3-,应生成NaHCO3,反应不能发生,故B错误;
C.酸性H2CO3>HClO>HCN,应生成NaHCO3,不能生成CO2,故C错误;
D.酸性C6H5OH>HCO3-,反应能发生,故D正确;
E.酸性H2CO3>C6H5OH>HCO3-,反应能发生,故E正确,
故答案为:BC;
(2)向50mL 0.018mol?L-1的AgNO3溶液中加入相同体积0.020mol?L-1的盐酸,盐酸过量,反应后的c(Cl-)=
| 0.02mol/L×0.05L-0.018mol/L×0.05L |
| 0.1L |
则c(Ag+)=
| Ksp(AgCl) |
| c(Cl-) |
| 1.8×10-10 |
| 0.001 |
故答案为:1.8×10-7 mol/L.
点评:本题考查越弱越水解、沉淀的溶度积计算,题目难度较大.

练习册系列答案
相关题目
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是( )
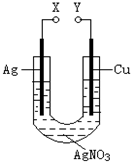

| A、X和Y不连接时,铜棒上会有金属银析出 |
| B、X和Y用导线连接时,银棒是正极,发生氧化反应 |
| C、若X接直流电源的正极,Y接负极,Ag+向铜电极移动 |
| D、无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色 |
在一定温度和压强下,2体积X2气体与3体积Y2气体恰好完全反应,生成2体积气体化合物Z,则Z的化学式可能是( )
| A、X2Y3 |
| B、XY |
| C、X2Y |
| D、XY3 |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4L水含有NA个H2O分子 |
| B、lmol Fe与足量氯气反应时失去的电子数为2NA |
| C、常温常压下,22.4LCl2含有2NA个Cl原子 |
| D、32g由氧气和臭氧组成的混合物中含有氧原子的数目为2NA |
某元素X核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1.下列有关X的说法中,不正确的是( )
| A、X能形成化学式为X(OH)3的碱 |
| B、X能形成化学式为NaXO3的含氧酸钠盐 |
| C、X原子的最外层电子数和核电荷数不可能为偶数 |
| D、X能与某些金属元素或非金属元素形成化合物 |
胶体区别于其它分散系最本质的特征是( )
| A、外观澄清、透明 |
| B、分散质粒子能透过半透膜 |
| C、丁达尔现象 |
| D、胶体粒子直径在1~100nm之间 |
分类是化学学习与研究的常用方法,下列分类正确的是( )
| A、Na2O2、MgO、Al2O3均属于碱性氧化物 |
| B、纯碱、烧碱、熟石灰均属于碱 |
| C、酸、碱、盐之间发生的反应均属于复分解反应 |
D、 混合物、分散系、胶体从属关系如图所示 混合物、分散系、胶体从属关系如图所示 |
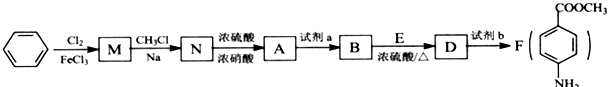
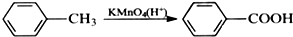
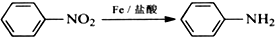
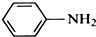 苯胺,弱碱性,-NH2易被氧化成-NO2
苯胺,弱碱性,-NH2易被氧化成-NO2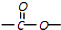 结构;
结构;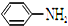 最多能够和
最多能够和