题目内容
1.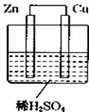 如图所示是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )实验后的记录:
①Zn为正极,Cu为负极
②Cu极上有气泡产生,发生还原反应
③SO42-向Zn极移动
④若有 0.5mol电子流经导线,则产生 5.6L气体(标况)
⑤电流的流向是:Cu $\stackrel{经导线}{→}$Zn
⑥负极反应式:Cu-2e-═Cu2+,发生氧化反应.
| A. | ②④⑤ | B. | ②③④⑤ | C. | ①④⑥ | D. | ③④⑤⑥ |
分析 Zn-Cu原电池中,Zn作负极,发生电池反应Zn+2H+=Zn2++H2↑,电子由负极流向正极,阴离子向负极移动,以此来解答.
解答 解:①Zn为负极,Cu为正极,故①错误;
②Cu电极上发生2H++2e-=H2↑,所以Cu极上有气泡产生,发生还原反应,故②正确;
③SO42-向负极锌极移动,故③正确;
④由2H++2e-=H2↑可知,有0.5mol电子流向导线,产生氢气0.25mol,则产生 5.6L气体(标况),故④正确;
⑤电子由Zn电极经导线流向Cu电极,电流与电子运动方向相反,故⑤正确;
⑥负极反应式:Zn-2e-═Zn2+,发生氧化反应,故⑥错误;
故选B.
点评 本题考查原电池,为高频考点,明确电极的判断、发生的电极反应、电子、离子的移动方向即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.关于化合物的下列说法中正确的是( )
| A. | 熔化状态下不导电的化合物一定是共价化合物 | |
| B. | 只含有共价键的物质一定是共价化合物 | |
| C. | 由两种不同的原子组成的纯净物一定是化合物 | |
| D. | 不含非极性键的晶体一定是共价化合物 |
6.向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色.再向反应后的混合物中不断通入SO2气体,溶液逐渐变为无色.下列分析正确的是( )
| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
13.能正确表示下列反应的离子方程式是( )
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫化钠的水解反应:S2-+H3O+HS-+H2O | |
| D. | 将0.2 mol•L-1的NH4Al(SO4)2溶液与0.3 mol•L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
10.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域.下列关于镁铝合金的性质的叙述中正确的是( )
| A. | 此合金的熔点、硬度比镁和铝的熔点、硬度都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 比合金不能全部溶解于过量Fe2Cl3溶液中 |
14.下列关于化学键的说法中不正确的是( )
| A. | 化学键是一种作用力 | |
| B. | 氢键也属化学键 | |
| C. | 化学键可以使离子相结合,也可以使原子相结合 | |
| D. | 化学方应过程中,反应物分子内的化学键断裂,生成物中的化学键形成 |
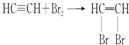
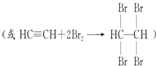
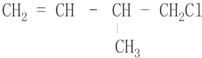
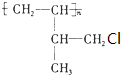 .
. .
.