题目内容
如图是某市售盐酸试剂瓶标签上的部分数据.则该盐酸的物质的量浓度是( )


| A、3 mol/L |
| B、8.4 mol/L |
| C、11.8 mol/L |
| D、0.5 mol/L |
考点:物质的量浓度的相关计算
专题:计算题
分析:根据c=
计算盐酸的物质的量浓度.
| 1000ρw |
| M |
解答:
解:盐酸的物质的量浓度为c=
=
mol/L=11.8moL/L,
故选C.
| 1000ρw |
| M |
| 1000×1.18×36.5% |
| 36.5 |
故选C.
点评:本题考查物质的量的有关计算,题目难度不大,注意公式法的应用,注意理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有关下列四个常用电化学装置的叙述中,正确的是( )
 |  | 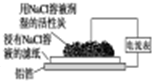 |  |
| 图Ⅰ碱性 锌锰电池 | 图Ⅱ铅硫 酸蓄电池 | 图Ⅲ铝箔的腐蚀 | 图Ⅳ银锌 纽扣电池 |
| A、图Ⅰ所示电池中,MnO2的作用是催化剂,负极反应为:Zn-2e-=Zn2+ |
| B、图Ⅱ所示电池充电过程中,硫酸浓度不断增大,阴极反应为:Pb+SO42-=PbSO4-2e- |
| C、铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-═Cl2↑ |
| D、图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag |
下列能使反应2HCl+2Ag═2AgCl+H2↑的方案是( )
A、 |
B、 |
C、 |
D、 |
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g);△H=-71kJ?mol-1
②CO(g)+2H2(g)=CH3OH(l);△H=-90.5kJ?mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ?mol-1
下列说法不能得出的结论是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g);△H=-71kJ?mol-1
②CO(g)+2H2(g)=CH3OH(l);△H=-90.5kJ?mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ?mol-1
下列说法不能得出的结论是( )
| A、反应②在任何温度下均能自发进行 |
| B、CO(g)+2H2(g)=CH3OH(g)△H>-90.5 mol?L-1 |
| C、甲醇的标准燃烧热为△H=-764 kJ?mol-1 |
| D、若CO的标准燃烧热为△H=-282.5 kJ?mol-1,则H2标准燃烧热为△H=-286 kJ?mol-1 |
煤的气化是工业生产中煤的综合利用的方法之一.已知下列热化学方程式:
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
②H2(g)+
O2(g)=H2O(g)△H2=-242.0kJ?mol-1
③CO(g)+
O2(g)=CO2(g)△H3=-283.0kJ?mol-1
④C(s)+H2O(g)=CO(g)+H2(g)△H4,则△H4为( )
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
④C(s)+H2O(g)=CO(g)+H2(g)△H4,则△H4为( )
| A、-131.5kJ?mol-1 |
| B、+352.5kJ?mol-1 |
| C、-352.5kJ?mol-1 |
| D、+131.5kJ?mol-1 |
下列说法不正确的是( )
| A、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| B、雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶 |
| C、化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 |
| D、据测定,许多反应的温度每升高10K,其反应速率增加2~4倍.在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率 |
相同物质的量的下列物质:①金属钠 ②烧碱 ③过氧化钠 ④氧化钠,长期放置在空气中(不考虑潮解和水解),最后质量都会增加,按增加的质量由大到小排列,正确的是( )
| A、①>②>④>③ |
| B、①>②>③>④ |
| C、④>①>③>② |
| D、④>①>②>③ |
 某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6mol?L-1稀H2SO4中,乙同学将电极放入6mol?L-1的NaOH溶液中,如图所示.
某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6mol?L-1稀H2SO4中,乙同学将电极放入6mol?L-1的NaOH溶液中,如图所示.
 是一种酯类物质,回答下列问题:
是一种酯类物质,回答下列问题: ,Ⅱ有两种同分异构体在一定条件下可相互反应生成
,Ⅱ有两种同分异构体在一定条件下可相互反应生成 ,这两种同分异构体的结构简式分别为
,这两种同分异构体的结构简式分别为