题目内容
16.下列有关说法正确的是( )| A. | HClO是弱酸,但它的氧化能力很强 | |
| B. | S在纯净的氧气中易被氧化为SO3 | |
| C. | 在氯酸钾溶液中含有少量自由移动的氯离子 | |
| D. | 22.4LCl2(标准状况),在反应中总是转移2NA个电子 |
分析 A.次氯酸在水溶液中存在电离平衡属于弱酸,但+1价的氯元素具有强氧化性;
B.硫在纯净氧气中反应生成二氧化硫;
C.氯酸钾溶液中存在钾离子和氯酸根离子,无氯离子;
D.氯气发生氧化还原反应可以是自身氧化还原反应,也可是只做氧化剂发生氧化还原反应;
解答 解:A.次氯酸在水溶液中存在电离平衡属于弱酸,HClO?H++ClO-,但次氯酸具有不稳定性分解生成氧气和盐酸,具有强氧化性可以漂白有色物质,杀菌消毒等,故A正确;
B.硫在空气中或纯净氧气中反应只能生成二氧化硫,不能一步生成三氧化硫,故B错误;
C.在氯酸钾溶液中存在钾离子和氯酸根离子,不含有少量自由移动的氯离子,故C错误;
D.氯气发生氧化还原反应可以是自身氧化还原反应,如氯气和氢氧化钠溶液的反应,也可是只做氧化剂发生氧化还原反应,如氯气和碘化钾反应生成碘单质和氯化钾,所以22.4LCl2(标准状况),在反应中转移电子可以是NA或2NA,故D错误;
故选A.
点评 本题考查了物质性质、物质构成、氧化还原反应原理,注意知识积累,题目较简单.

练习册系列答案
相关题目
6.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )
| A. | c(H+)<c(OH-) | B. | c(HCN)<c(CN-) | ||
| C. | c(CN-)+c(OH-)=0.1mol?L-1 | D. | c(HCN)+c(CN-)=0.2mol?L-1 |
7.下列关于性质或用途的说法正确的是( )
| A. | 某物质灼烧时,火焰颜色为黄色,则该物质为金属钠 | |
| B. | 工业制造镁粉是将镁蒸气放在氮气中冷却 | |
| C. | 钠的化学性质很活泼,所以在自然界中只能是以游离态的形式存在 | |
| D. | 钠钾合金可以用于快中子反应堆作热交换剂 |
4.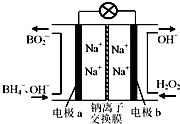 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 电池放电时Na+从a极区移向b极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
11.下列反应中的氨与反应4NH3+5O2═4NO+6H2O中的氨作用相同的是( )
| A. | NaOH+NH4Cl═NaCl+NH3↑+H2O | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | 2Na+2NH3═2NaNH2+H2↑ | D. | NH3+CO2+H2O═NH4HCO3 |
1.下列实验操作正确的是( )
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,则该溶液一定是碳酸盐溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | 中和热测定实验中,要将酸和碱迅速混合,以防热量散失 |
8.下列物质间的转化不能通过一步反应完成的是( )
| A. | CO2→C | B. | Al2O3→NaAlO2 | C. | SiO2→Si | D. | SiO2→H2SiO3 |
3.对于某些离子的检验及结论一定正确的是( )
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42- | |
| B. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明有Cl- | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液中一定有CO32- | |
| D. | 加入氯水后,滴加KSCN溶液,溶液变红,原溶液中一定有Fe2+ |