题目内容
11.将50g密度ρ=0.98g/mL的10%的氨水和100g密度ρ=0.93g/mL的40%的氨水混合,得到ρ=0.95g/mL氨水溶液,求所得氨水的物质的量浓度是多少?分析 分别计算出50g ρ=0.98g/mL的10%的氨水、100g ρ=0.93g/mL的40%的氨水中含有溶质氨气的质量及混合液的质量,再根据n=$\frac{m}{M}$计算出氨气的物质的量,然后根据V=$\frac{m}{ρ}$计算出混合液的体积,最后根据c=$\frac{n}{V}$计算出所得氨水的物质的量浓度.
解答 解:50g ρ=0.98g/mL的10%的氨水中含有氨气的质量为:50g×10%=5g,100g ρ=0.93g/mL的40%的氨水中含有氨气的质量为:100g×40%=40g,则混合液中氨气的总质量为:5g+40g=45g,氨气的物质的量为:$\frac{45g}{17g/mol}$≈2.65mol,
混合液的质量为:100g+50g=150g,混合液体积为:$\frac{150g}{0.95g/mL}$≈157.89mL≈0.158L,
则所得氨水的物质的量浓度为:$\frac{2.65mol}{0.158L}$≈16.8mol/L
答:所得氨水的物质的量浓度为16.8mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,正确利用题中数据为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
2.下列电离方程式中,正确的是( )
| A. | NaOH=Na++OH- | B. | Na2SO4=2Na++SO4-2 | ||
| C. | H2SO4=H2++SO42- | D. | Ca(NO3)2=Ca2++2(NO3)2- |
6.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温下,1L 0.1mol/L HCl溶液中含氢原子数是0.1NA | |
| B. | 标准状况下,2.24L由CO2和O2组成的混合气体中含氧分子数是0.1NA | |
| C. | 10g碳酸钙与足量的稀盐酸充分反应消耗的氢离子数为0.1NA | |
| D. | 标准状况下,11.2L CO和 NO混合气体中与11.2LN2中分子数均为0.5NA |
16.日常生活和工业生产中常用到漂白剂.下列溶液不具有漂白作用的有( )
| A. | NaClO溶液 | B. | Na2O2 | C. | 新制氯水 | D. | 稀H2SO4 |
3.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
| A. | 两种气体的压强相等 | B. | O2和O3的原子个数相等 | ||
| C. | 两种气体的氧化能力相同 | D. | 两种气体的分子数目相等 |
20.下列有关方程式书写正确的是( )
| A. | 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-═H2O | |
| B. | H2S在水溶液中的电离:H2S+H2O?H3O++HS- | |
| C. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| D. | NH4HCO3溶于过量的NaOH溶液中:HCO32-+OH-═CO32-+H2O |
1.下列离子方程式中,不正确的是( )
| A. | 高锰酸钾酸性溶液与草酸钾溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | KI的酸性溶液长期置于空气中::4I-+4H++O2═2I2+2H2O | |
| C. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O | |
| D. | 用食醋除去水垢:CO32-+2CH3COOH═H2O+CO2↑+2CH3COO- |

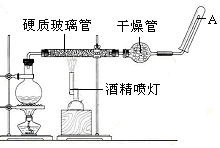 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.