题目内容
20.下列有关方程式书写正确的是( )| A. | 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-═H2O | |
| B. | H2S在水溶液中的电离:H2S+H2O?H3O++HS- | |
| C. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| D. | NH4HCO3溶于过量的NaOH溶液中:HCO32-+OH-═CO32-+H2O |
分析 A.醋酸在离子反应中保留化学式;
B.电离分步进行,以第一步为主;
C.燃烧热中水为液态;
D.漏写铵根离子与碱的反应.
解答 解:A.醋酸溶液与氢氧化钠溶液反应的离子方程式为CH3COOH++OH-═CH3COO-+H2O,故A错误;
B.H2S在水溶液中的电离为H2S+H2O?H3O++HS-,故B正确;
C.甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故C错误;
D.NH4HCO3溶于过量的NaOH溶液中的离子反应为NH4++HCO3-+2OH-═CO32-+H2O+NH3.H2O,故D错误;
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
10.设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 在常温常压下,11.2 g O2含有的分子数为0.5NA | |
| B. | 71 g Cl2所含原子数为2NA | |
| C. | 标准状况下,22.4 L H2O含有的分子数为1NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
15.一定条件下的2L密闭容器,进行反应2X(g)+Y(g)?2Z(g),若起始时X、Y、Z物质的量分别为n1、n2、n3(均不为零).达平衡时,X、Y、Z浓度分别为0.2mol/L、0.1mol/L和0.08mol/L,则下列判断合理的是( )
| A. | X和Y的转化率不一定相等 | B. | n1、n2=2:1 | ||
| C. | 平衡时,Y和Z的生成速率之比为2:1 | D. | n,的取值范围为0<n1<0.28 |
5.在某学生的化学实验中,有如下记录,其中能达到测量要求的是( )
| A. | 用托盘天平称取35.20g NaCl | B. | 用10mL量筒量取8.5 mL盐酸 | ||
| C. | 用50 mL 烧杯量取15.80 mL溶液 | D. | 用250 mL 容量瓶量取25 mL溶液 |
12.下列说法正确的是( )
| A. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸 | |
| D. | 欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2并加热 |
10.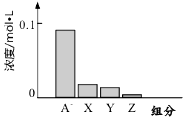 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )
 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |