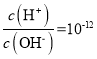题目内容
【题目】常温下,pH=12的氢氧化钠和pH=4的醋酸等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合后的溶液呈中性B.混合前两溶液中水的电离程度不同
C.氢氧化钠和醋酸的浓度不相等D.混合前的醋酸约1%发生电离
【答案】D
【解析】
常温下,pH=12的氢氧化钠和pH=4的醋酸等体积混合后恰好中和,则表明氢氧化钠与醋酸刚好完全反应,c(CH3COOH)=10-2mol/L。
A. 二者混合后刚好完全反应,生成CH3COONa,CH3COONa为强碱弱酸盐,溶液呈碱性,A错误;
B. 混合前碱溶液中c(OH-)=10-2mol/L,酸溶液中的c(H+)=10-4mol/L,碱对水电离的抑制作用强,水的电离程度前者小于后者,B错误;
C. 由前面计算知,c(NaOH)=10-2mol/L,c(CH3COOH)=10-2mol/L,氢氧化钠和醋酸的浓度相等,C错误;
D. 混合前c(CH3COOH)=10-2mol/L,电离产生的c(H+)=10-4mol/L,醋酸的电离度为
![]() ,即醋酸约有1%发生电离,D正确。
,即醋酸约有1%发生电离,D正确。
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 0.5molA 1.5 molB | 0.5 molA 1.5 molB | 2.0 molA 6.0 molB |

下列说法正确的是
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.l0min内甲容器中反应的平均速率v(B)=0.025mol·(L·min)-1
D.T1℃,若起始时甲容器中充入1.5molA、0.5molB,平衡时B的转化率为25%