题目内容
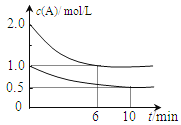
【题目】(1)室温下在pH =5的醋酸稀溶液中, 醋酸电离出的c(H+)的精确值是__molL-1,水电离出的c(H+)是__molL-1。
(2)写出下列反应的离子方程式:①草酸溶液中滴入酸性高锰酸钾溶液___;
②铬酸钾溶液中滴入稀硫酸___;
(3)反应I2+2S2O32-=2I-+S4O62-常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择___(填序号)。
①1mL0.01molL-1的碘水 ②1mL0.001molL-1的碘水
③4mL0.01molL-1的Na2S2O3溶液 ④4mL0.001molL-1的Na2S2O3溶液
若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32-)=__。
【答案】10-5-10-9 10-9 5H2C2O4+2MnO4-+ 6H+=2Mn2++10CO2↑+8H2O 2CrO42-+2H+=Cr2O72-+H2O ②③④ 8.3×10-4molL-1s-1
【解析】
(1)室温下在pH =5的醋酸稀溶液中,H+主要来自醋酸电离,但水也会发生电离,所以溶液中的c(H+)实际上是醋酸电离出的H+与水电离出的H+的浓度之和;在此醋酸溶液中水电离出的c(H+)与水电离出的c(OH-)相等,也等于溶液中的c(OH-);
(2)反应的离子方程式:①草酸溶液中滴入酸性高锰酸钾溶液,会发生氧化还原反应,H2C2O4被氧化为CO2,KMnO4中的锰被还原为Mn2+;
②铬酸钾溶液中滴入稀硫酸,CrO42-在酸性溶液中转化为Cr2O72-;
(3)要探究浓度对反应速率的影响,则反应物的浓度应该是不同的,根据反应方程式可知,如果选择试剂①,则④的Na2S2O3溶液不足量。因此我们选择②③④;
若某同学选取①③进行实验,则参加反应的Na2S2O3的物质的量为2mL×0.01molL-1,溶液的体积为6mL,测得褪色时间为4s,从而可计算出v(S2O32-)。
(1)室温下在pH =5的醋酸稀溶液中,H+主要来自醋酸电离,但水也会发生电离,所以溶液中的c(H+)实际上是醋酸电离出的c(H+)(即为10-5mol/L)与水电离出的c(H+)之和;在此醋酸溶液中水电离出的c(H+)与水电离出的c(OH-)相等,也等于溶液中的c(OH-)(即为10-9mol/L);因此醋酸电离出的c(H+)的精确值是(10-5-10-9)molL-1,水电离出的c(H+)是10-9molL-1;答案为:10-5-10-9;10-9;
(2)①草酸溶液中滴入酸性高锰酸钾溶液,会发生氧化还原反应,H2C2O4被氧化为CO2,C由+3价升高到+4价,KMnO4中的锰被还原为Mn2+,Mn由+7价降低到+2价,按电子守恒,有下列关系式,5H2C2O4—2KMnO4,反应的离子方程式为:
5H2C2O4+2MnO4-+ 6H+=2Mn2++10CO2↑+8H2O;答案为:5H2C2O4+2MnO4-+ 6H+=2Mn2++10CO2↑+8H2O;
②铬酸钾溶液中滴入稀硫酸,CrO42-转化为Cr2O72-,反应的离子方程式为2CrO42-+2H+=Cr2O72-+H2O;答案为:2CrO42-+2H+=Cr2O72-+H2O;
(3)要探究浓度对反应速率的影响,则反应物的浓度应该是不同的,根据反应方程式可知,如果选择试剂①,则④的Na2S2O3溶液不足量。因此我们选择②③④;
若某同学选取①③进行实验,则参加反应的Na2S2O3的物质的量为2mL×0.01molL-1,溶液的体积为6mL,测得褪色时间为4s,从而可计算出v(S2O32-)=![]() molL-1s-1。答案为:②③④;8.3×10-4molL-1s-1。
molL-1s-1。答案为:②③④;8.3×10-4molL-1s-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇时,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1
CH3OH(g) △H1= -99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= 58kJmol-1
CH3OH(g)+H2O(g) △H2= 58kJmol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1
CO(g)+H2O(g) △H3=+41kJmol-1
(1)一定温度下,向体积为2L的密闭容器中加入CO和H2,假设只发生反应①,达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①列式并计算平衡常数K=___。
②若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是___。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__v逆(填“>”、“<”或“=”)。
(2)在实际生产中,当合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示。
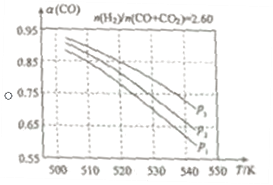
α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图中的压强由大到小为___,其判断理由是___。