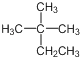
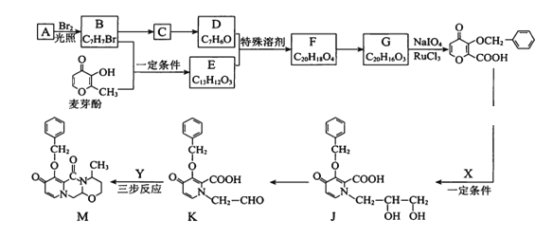
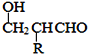题目内容
【题目】能正确表达下列反应的离子方程式为
A.用醋酸除去水垢:2H++CaCO3![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS![]() H2S↑+Fe2+
H2S↑+Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-![]() Al2(CO3)3↓
Al2(CO3)3↓
D.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
【答案】D
【解析】
A.醋酸和碳酸钙都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH═Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.硫化亚铁与浓硫酸混合加热,发生氧化还原反应生成Fe2(SO4)3、SO2、S和H2O,故B错误;
C.铝离子水解显酸性,碳酸根离子水解显碱性,混合后水解相互促进生成氢氧化铝和二氧化碳,反应的离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故C错误;
D.电解饱和食盐水获取烧碱和氯气,发生反应的离子方程式为:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-,故D正确;
H2↑+Cl2↑+2OH-,故D正确;
故答案为D。

 名校课堂系列答案
名校课堂系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为______(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是_____。(用化学式回答)
(3)由①、④、⑤三种元素形成化合物的电子式______ 。
(4)⑥的单质与NaOH溶液反应的离子方程式_______。
(5)⑦的氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1 g氢化物自燃放出45.0 kJ的热量(产物水为液态),其热化学方程式为_________。
(6)由表中元素形成的常见物质A、B、C、D、E、F转化关系如下图所示。已知:A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体, E的相对分子质量比D大17 ,D为红棕色气体(部分反应中生成物没有全部列出,反应条件未列出)

①A的结构式为_______。
②A和B反应生成C和F的化学方程式为_______,反应Ⅰ的离子方程式为________。