题目内容
从下列事实所得的相应结论正确的是( )
| 实验事实 | 结论 | |
| A | 常温下白磷可自燃,而氮气要在放电条件下才与氧气反应 | 非金属性:P>N |
| B | 乙醇与浓H2SO4共热至170℃可产生乙烯,将乙烯通入酸性KMnO4溶液,红色褪去 | 乙烯具有漂白性 |
| C | SO2通入溴水溶液,溶液褪色 | SO2有漂白性 |
| D | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 同浓度的pH:NaAlO2>NaHCO3 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价,非金属在元素周期表中的位置及其性质递变的规律,盐类水解的原理,二氧化硫的化学性质,乙烯的化学性质
专题:实验评价题
分析:A.比较非金属性的角度错误;
B.乙烯与酸性高锰酸钾发生氧化还原反应;
C.二氧化硫与溴水发生氧化还原反应;
D.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明AlO2-易结合氢离子.
B.乙烯与酸性高锰酸钾发生氧化还原反应;
C.二氧化硫与溴水发生氧化还原反应;
D.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明AlO2-易结合氢离子.
解答:
解:A.比较非金属性,可从氢化物的稳定性或对应的最高价氧化物的水化物的酸性强弱比较,故A错误;
B.乙烯与酸性高锰酸钾发生氧化还原反应,故B错误;
C.二氧化硫与溴水发生氧化还原反应,二氧化硫表现还原性,故C错误;
D.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明AlO2-易结合氢离子,可说明同浓度的pH:NaAlO2>NaHCO3,故D正确.
故选D.
B.乙烯与酸性高锰酸钾发生氧化还原反应,故B错误;
C.二氧化硫与溴水发生氧化还原反应,二氧化硫表现还原性,故C错误;
D.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明AlO2-易结合氢离子,可说明同浓度的pH:NaAlO2>NaHCO3,故D正确.
故选D.
点评:本题考查较为综合,涉及物质的性质的比较,为高频考点,注意把握金属性、非金属性比较的角度,难度不大,易错点为D.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
把a L含(NH4)2SO4和NH4NO3的混合液分成2等份,一份用bmol的NaOH刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol的BaCl2,则原溶液中c(NO3-)为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为( )
| A、0.5(a+b) mol |
| B、(a-b) mol |
| C、0.5(a-b) mol |
| D、(a+b)mol |
下列实验装置不能达到相应实验目的是( )
A、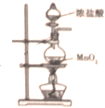 制取氯气的发生装置 |
B、 除去粗盐溶液中的难溶物 |
C、 蒸干氯化铝溶液制AlCl3?6H2O晶体 |
D、 除去氯气中的少量氯化氢 |
下列气体的收集方法正确的是( )
A、 |
B、 |
C、 |
D、 |
下列物质在空气中放置一段时间后,质量会减轻的是( )
| A、固体碳酸钙 | B、碳酸钠晶体 |
| C、浓硫酸 | D、氯化钠固体 |
