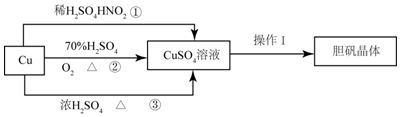
题目内容
9.表中,对陈述 I、II的正确性及两者之间因果关系的判断、完全正确的是:( )| 陈述 I | 陈述 II | 判断 | |
| A | SO2可使酸性高锰酸钾溶液腿色 | 因为SO2具有漂白性 | I对,II对,有 |
| B | 铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 | 因为铁和铝不能与浓硝酸或浓硝酸反应 | I对,II对,无 |
| C | 铝箔在酒精灯火焰上,加热后熔化但液态铝不滴落 | 因为铝在空气中氧化生成一层薄薄的致密氧化膜,熔点高,而金属铝的熔点较低 | I对,II对,有 |
| D | 高压钠灯发出透雾性强的黄光 | 因为金属钠具有强还原性 | I对,II对,有 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫被酸性高锰酸钾溶液氧化,二氧化硫表现了还原性;
B.铁和铝与浓硫酸或浓硝酸发生钝化反应;
C.铝与氧气反应生成氧化铝的熔点高;
D.钠的焰色反应为黄色,属于物理性质.
解答 解:A.SO2可使酸性高锰酸钾溶液腿色,原因是二者发生氧化还原反应,二氧化硫表现了还原性,不是漂白性,故A错误;
B.铁和铝与浓硫酸或浓硝酸发生钝化,不是不反应,所以I对,II不对,故B错误;
C.铝与氧气反应生成氧化铝的熔点高,则铝箔在酒精灯火焰上加热熔化但不滴落,I对,II对,有因果关系,故C正确;
D.钠的焰色反应为黄色,与还原性无关,故D错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度不大,涉及焰色反应、铁、铝的性质、二氧化硫的性质等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
19.只用一种试剂区别MgSO4、FeSO4、Al2(SO4)3、(NH4)2SO4四种溶液,这种试剂是( )
| A. | BaCl2 | B. | H2SO4 | C. | AgNO3 | D. | NaOH |
17.下列实验事实得出的结论不正确的是( )
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
| C | 将SO2通入含HClO的溶液中,生成H2SO4 | HClO酸性比H2SO4强 |
| D | 向FeCl2溶液中滴入KSCN溶液,在液面出现血红色 | Fe2+在空气中被氧化 |
| A. | A | B. | B | C. | C | D. | D |
14.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| B. | 标准状况下,22.4LSO3所含的分子数为NA个 | |
| C. | 足量铜与11.18mol/L浓硫酸反应可以得到SO2的分子数总数为9NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为2NA |
18.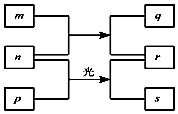 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | |
| B. | 元素的非金属性Z>X>Y | |
| C. | Y的氢化物常温常压下为气态 | |
| D. | X的最高价氧化物对应的水化物为弱酸 |
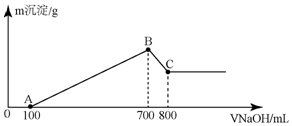 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:
将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白: