题目内容
16.在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol•L-1和1.5mol•L-1,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )| A. | 反应后溶液中Fe3+物质的量为0.8 mol | |
| B. | 反应后产生13.44 L H2(标准状况) | |
| C. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 | |
| D. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
分析 Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性大小为:HNO3>Fe3+>H+,先发生反应Fe+4H++NO3-═Fe3++NO↑+2H2O、再发生反应Fe+2Fe3+═3Fe2+,若还有Fe剩余,则最后发生Fe与氢离子的反应,以此来解答.
解答 解:Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性为HNO3>Fe3+>H+,则
Fe+4H++NO3-═Fe3++NO↑+2H2O
1 4 1 1
0.6 2.4 0.6 0.6
Fe+2Fe3+═3Fe2+,
1 2 3
0.1 0.2 0.3
Fe完全反应,没有剩余,溶液中存在0.6molFe3+、0.3molFe2+,
A.反应后溶液中Fe3+物质的量为0.6mol,故A错误;
B.不会发生反应Fe+2H+═Fe2++H2↑,则没有氢气生成,故B错误;
C.氧化性为HNO3>Fe3+>H+,先发生反应Fe+4H++NO3-═Fe3++NO↑+2H2O,有气体生成,故C错误;
D.反应后溶液中存在0.6molFe3+、0.3molFe2+,反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol,故D正确;
故选D.
点评 本题考查混合物反应的计算,题目难度中等,明确发生的化学反应及反应的先后是解答本题的关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
6.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | 漂白粉溶液中通入足量二氧化硫气体:ClO-+SO2+H2O═HClO+HSO${\;}_{3}^{-}$ | |
| C. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
11.根据表提供的数据,下列判断正确的是( )
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7Ka2=5.6×10-11 |
| A. | 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(CH3COO-) | |
| B. | 常温下,已知酸H2A存在如下平衡:H2A═H++HA-;HA-═H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5 |
1.下列反应的离子方程式书写正确的是( )
| A. | 小苏打和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化铝溶于强碱:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 氢氧化钡溶液与硫酸溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与醋酸反应:CO32-+2H+═H2O+CO2↑ |
8.短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13.X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素.下列说法正确的是( )
| A. | 简单离子半径的大小顺序:r(W)>r(Y)>r(Z) | |
| B. | 元素Z、W 的简单离子的电子层结构不同 | |
| C. | 元素Y 的简单气态氢化物的热稳定性比Z 的强 | |
| D. | W、Y、Z 三种元素的氢化物中,W的熔点最高 |
5.锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.请回答下列问题:
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系.
由此可得出的判断含氧酸强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.亚磷酸(H3PO3)也是中强酸,它的结构式为 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 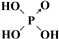 | 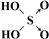 | 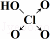 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O. 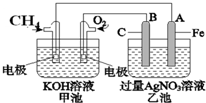 如图是一个电化学过程的示意图.已知甲池的总反应式为
如图是一个电化学过程的示意图.已知甲池的总反应式为