题目内容
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗x mol H2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)/mol?L-1为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:离子方程式的有关计算
专题:计算题
分析:第一份溶液中发生的反应为BaCl2+H2SO4=BaSO4↓+2HCl,根据n(H2SO4)计算n(BaCl2);第二份溶液中发生的反应为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2、NaCl+AgNO3=AgCl↓+NaNO3,根据n(BaCl2)计算和BaCl2反应的n(AgNO3),剩余AgNO3和NaCl反应生成AgCl,据此计算NaCl物质的量,再结合C=
计算c(Na+).
| n |
| V |
解答:
解:第一份溶液中发生的反应为BaCl2+H2SO4=BaSO4↓+2HCl,根据BaCl2---H2SO4知,n(H2SO4)=n(BaCl2)=xmol; 第二份溶液中发生的反应为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2、NaCl+AgNO3=AgCl↓+NaNO3,根据BaCl2---2AgNO3知,和BaCl2反应的n(AgNO3)=2n(BaCl2)=2xmol,则剩余AgNO3和NaCl反应生成AgCl,根据NaCl---AgNO3知,和NaCl反应的硝酸银物质的量n(AgNO3)=n(NaCl)=ymol-2xmol,则两种溶液中NaCl的物质的量为2ymol-4xmol,根据Na原子守恒知,n(Na+)=n(NaCl)=2ymol-4xmol,则原来混合溶液中c(Na+)=
=
mol/L,故选D.
| 2ymol-4xmol |
| aL |
| 2y-4x |
| a |
点评:本题考查离子方程式计算,明确物质之间的反应是解本题关键,侧重考查学生分析问题、计算能力,注意溶液体积大小判断,为易错题.

练习册系列答案
相关题目
下列有关0.1mol/LNaOH 溶液的叙述正确的是( )
| A、该溶液中含有NaOH4g |
| B、100ml该溶液中含有Na+0.01mol |
| C、从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol/L |
| D、在1L水中溶解4g NaOH即可配制得0.1 mol/L NaOH溶液 |
25℃时,弱酸的电离平衡常数如表所示,下列离子反应方程式错误的是( )
| 弱酸 | H2SO3 | HClO | H2CO3 |
| Ka1 | 1.54×10-2 | 2.95×10-8 | 4.30×10-7 |
| Ka2 | 1.02×10-7 | 5.61×10-11 |
| A、氯水中加入少量NaHCO3粉末:HCO3-+H+=H2O+CO2↑ |
| B、NaAl(OH)4溶液中通入足量的CO2:Al(OH)4-+CO2=Al(OH)3↓+HCO3- |
| C、NaClO溶液中通入少量CO2:2ClO-+H2O+CO2=CO32-+2HClO |
| D、Na2CO3溶液中通入少量SO2:2 CO32-+H2O+SO2=SO32-+2HCO3- |
将下列物质按酸、碱、盐分类排列,正确的是( )
| A、H2SO4、纯碱、食盐 |
| B、HI、烧碱、胆矾 |
| C、H2CO3、乙醇、醋酸钠 |
| D、H3PO4、熟石灰、苛性钾 |
下列物质属于电解质的是( )
| A、石墨 | B、蔗糖 |
| C、稀硫酸 | D、NaCl |
下列物质与危险化学品标志的对应关系正确的是( )
| A | B | C | D |
| 金属钠 | 乙醇 | 浓硫酸 | 乙酸 |
 |  |  |  |
| A、A | B、B | C、C | D、D |
用下列装置不能达到有关实验目的是( )
A、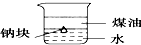 证明ρ(煤油)<ρ(钠)<ρ(水) |
B、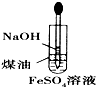 制备Fe(OH)2 |
C、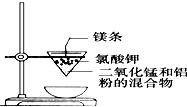 制取金属锰 |
D、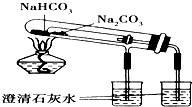 比较NaHCO3和Na2CO3的热稳定性 |
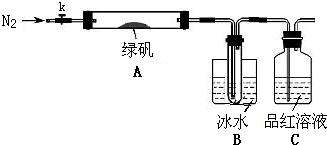 某学习小组拟通过实验探究绿矾(FeSO4?7H2O)热分解的产物.
某学习小组拟通过实验探究绿矾(FeSO4?7H2O)热分解的产物.